
����Ŀ��ﮣ�������ͭ��������Ļ���������Cu4O(PO4)2,��ͨ�����з�Ӧ�Ʊ���2Na3PO4��4CuSO4��2NH3��H2O=Cu4O(PO4)2����3Na2SO4��(NH4)2SO4��H2O.��ش��������⣺
(1)д����̬Cu2+����Χ�����Ų�ʽ��__________.C��N��O����Ԫ�صĵ�һ��������С�����˳��Ϊ__________(��Ԫ�ط��ű�ʾ).
(2)PO43���Ŀռ乹����____________________________________________.
(3)��������ͭ�ķ��ӽṹ��ͼ,����̼ԭ�ӵ��ӻ���ʽΪ______________.

(4)����ͭ����Ҫ�Ľ���,Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ������.�������������[Fe(CN)6]4���в�����___________________.
A.���ۼ� B.�Ǽ��Լ� C.��λ�� D.���� E.����
(5)������ͭ��Һ�м��������ˮ,��������������İ���ͭ����,��д���İ���ͭ���ӵĽṹʽ_________.
(6)NaCl��������r(Na��)=a pm,r(Cl��)=b pm,��NaCl�����Ŀռ�������Ϊ________.(�������������ܶѻ���ʽ����,�ú���a,b����ʽ��ʾ)
���𰸡�3d9 C��O��N �������� sp3��sp2 B 
![]()
��������
��1��ͭ��29��Ԫ�أ�����ͭ���Ӻ�����27�����ӣ����ݹ���ԭ��д�����������Ų�ʽ����ȷ������Χ�����Ų�ʽ������Ԫ�������ɱȽϵ��һ�����ܣ�
��2�����ݼ۲���ӶԻ�������ȷ����ռ乹�ͣ�
��3���ɰ�������ͭ��̼ԭ�ӵļ۲�������ֱ�Ϊ4��3����ȷ�����ӻ���ʽ��
��4����[Fe(CN)6]4���У�һ��CN���к���1��������2���м�����ÿ��CN-��Fe������λ�����ϣ�
��5��Cu����ԭ�ӣ�NH3�����壬ȷ����ṹʽ��
��6��NaCl����Ϊ���������ܶѻ������ı߳�Ϊ��2a+2b��pm�������Na+��Cl-��ռ����;���������Ӷ�������ռ���������
��1��ͭ��29��Ԫ�أ�����ͭ���Ӻ�����27�����ӣ����ݹ���ԭ��֪�����������Ų�ʽΪ��[Ar]3d9������Χ�����Ų�Ϊ3d9��ͬһ�����У�Ԫ�صĵ�һ����������ԭ�������������������VA��Ԫ�صĵ�һ�����ܴ���������Ԫ�أ�����C��N��OԪ�ص�һ������ΪC��O��N��
�ʴ�Ϊ��3d9��C��O��N��
��2��PO43����Pԭ�ӵļ۲���Ӷ�=4+![]() ��5+3��4��2��=4��Pԭ��Ϊsp3�ӻ����Ҳ����µ��Ӷԣ�������ռ乹���������壬
��5+3��4��2��=4��Pԭ��Ϊsp3�ӻ����Ҳ����µ��Ӷԣ�������ռ乹���������壬
�ʴ�Ϊ���������壻
��3����������ͭ�ķ����У�������һ��̼��̼��˫�������۲������Ϊ3������̼���ӻ���ʽΪsp2�ӻ�����һ��̼��Χ���ǵ��������۲������Ϊ4����̼���ӻ���ʽΪsp3�ӻ���
�ʴ�Ϊ��sp3��sp2��
��4����[Fe(CN)6]4���У�һ��CN���к���1��������2���м���C��N�Dz�ͬ��ԭ������Ϊ���Լ�����֮��Ϊÿ��CN����Fe������λ�����ϣ�
�ʴ�Ϊ��B��
��5����ΪCu����ԭ�ӣ�NH3�����壬����ȷ��ṹʽΪ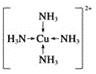 ��
��
�ʴ�Ϊ�� ��
��
��7�������й�����4��Na+��4����4��Cl�������Ϊ![]() �У�a3+b3����4�������ı߳�Ϊ2a+2b���������Ϊ��2a+2b��3���Ȼ��ƾ��������ӵĿռ�������Ϊ��
�У�a3+b3����4�������ı߳�Ϊ2a+2b���������Ϊ��2a+2b��3���Ȼ��ƾ��������ӵĿռ�������Ϊ��![]() 100%=
100%=![]() ��
��
�ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣�����ܱ������еķ�Ӧ:N2(g)+3H2(g)![]() 2NH3(g),673 K��30 MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����(����)
2NH3(g),673 K��30 MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����(����)

A. �����¶�,�淴Ӧ��������,����Ӧ���ʼ�С
B. ��c����Ӧ�ﵽƽ��
C. ��d(t1ʱ��)�͵�e(t2ʱ��)��n(N2)��һ��
D. ��a������Ӧ���ʱȵ�b�Ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ,B��D����ʳ�����ֳ������л���,F��һ������ζ������,F��̼ԭ������D������������AΪ��Ҫԭ�Ϻϳ�F�߷��ӻ�����E,��ϳ�·����ͼ��ʾ:
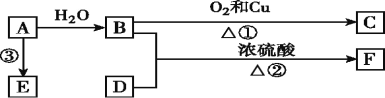
(1)A�ĽṹʽΪ_____��B�й����ŵ�����Ϊ____________��
(2)д����Ӧ�Ļ�ѧ����ʽ��
��_________________,��Ӧ����:______��
��________________,��Ӧ����:______��
(3)д��D������Ʒ�Ӧ�Ļ�ѧ����ʽ______________
(4)ʵ������������B��D?_________________��
(5)��B���������Ϊ75%��ˮ��Һ������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.8 mol��L��1�������жϴ�����ǣ�������
xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.8 mol��L��1�������жϴ�����ǣ�������
A. x��4 B. 2 min��B�ķ�Ӧ����Ϊ0.1 mol��(L��min)��1
C. ��������ܶȲ��䣬������÷�Ӧ�Ѵﵽƽ��״̬ D. B��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ��ͨ��һ��ʱ��������õ���Һ�м���0.1molCuO��ǡ�ûָ������ǰ��Ũ�ȣ����������ת�Ƶĵ�����Ϊ ( )
A.0.1 molB.0.2 molC.0.3 molD.0.4 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��3A(g)![]() 3B(��)+C(��)��H��0�������¶����ߣ�����ƽ����Է��������б�С���ƣ��������ж���ȷ����( )
3B(��)+C(��)��H��0�������¶����ߣ�����ƽ����Է��������б�С���ƣ��������ж���ȷ����( )
A. B��C���ܶ��ǹ��� B. ��CΪ���壬��Bһ��������
C. B��Cһ���������� D. B��C�����ܶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 mol A(g)��1 mol B(g)Ͷ��һ�ݻ��ɱ���ܱ����������������¿��淴Ӧ��A(g)+B(g)![]() xC(g)�����ⶨC�ڷ�Ӧ������е����ʵ�������(C%)��ʱ��(t)����ͼ����ʾ��ϵ���ɴ��ƶ�����˵������ȷ������ ��
xC(g)�����ⶨC�ڷ�Ӧ������е����ʵ�������(C%)��ʱ��(t)����ͼ����ʾ��ϵ���ɴ��ƶ�����˵������ȷ������ ��
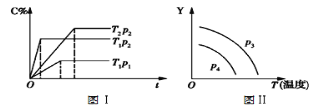
A. ���������淴Ӧ��x=3
B. �����������䣬������ʼͶ������Ϊ2 mol A(g)��2 mol B(g)���ﵽƽ��ʱ��C�����ʵ�����������
C. ��ͼ������P3>P4����Y��ɱ�ʾ��������ƽ��Ħ������
D. ��ͼ���У���Y��ɱ�ʾA��ת���ʣ�����P3<P4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ȫȼ�պ����ɶ�����̼��ˮ�����ʵ���֮��Ϊn����n-1�������������ǣ� ��
A.����B.��ϩ��C.Ȳ��D.����ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W���ֶ�����Ԫ�أ��й��������±�������������ȷ���ǣ� ��
Ԫ�ش��� | X | Y | Z | W |
ԭ�Ӱ뾶/pm | 66 | 70 | 143 | 160 |
��Ҫ���ϼ� | -2 | +5��+3��-3 | +3 | +2 |
A. W��Y�γɵĻ�����Ϊ���ۻ�����
B. Y������������Ӧ��ˮ����Ϊǿ��
C. Y�ļ���̬�⻯��ķе����X�ļ���̬�⻯��
D. ��ҵ�Ͼ������õ��Z���Ȼ�����Һ�Ʊ�Z����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com