
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJmol-1
2NO(g) △H=+180.5kJmol-1
③4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) △H=+l025kJmol-1
4NH3(g)+5O2(g) △H=+l025kJmol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
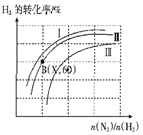
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3 从高到低的顺序是_________________;测得B(X,60)点时N2的转化率为50%,则X=________。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________。
【答案】 4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H=-1650kJ/mol BC CD P1>P2>P3 2∶5  NO+2H2O-3e-=4H++NO3-
NO+2H2O-3e-=4H++NO3-
【解析】(一)已知① H2O(g)=H2O(1) △H=-44kJmol-1,②N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJmol-1,③4NO(g)+6H2O(g)
2NO(g) △H=+180.5kJmol-1,③4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) △H=+l025kJmol-1,根据盖斯定律,将①×6-②×2-③得:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H=(-44kJmol-1)×6-(+180.5kJmol-1)×2-(+l025kJmol-1)=-1650kJ/mol,故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H=-1650kJ/mol;
4NH3(g)+5O2(g) △H=+l025kJmol-1,根据盖斯定律,将①×6-②×2-③得:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H=(-44kJmol-1)×6-(+180.5kJmol-1)×2-(+l025kJmol-1)=-1650kJ/mol,故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H=-1650kJ/mol;
(二)(1)A.及时分离出NH3,减小了氨气的浓度,平衡正向移动,能用勒夏特列原理解释,不选;B.使用铁触媒做催化剂,平衡不移动,不能用勒夏特列原理解释,选;C.正反应为放热反应,升高温度,平衡逆向移动,不利于氨的合成,反应温度控制在500℃左右是提高反应速率和催化剂的活性,不能用勒夏特列原理解释,选;D.该反应属于气体体积减小的反应,增大压强有利于平衡正向移动,能用勒夏特列原理解释,不选;故选BC;
(2)A.单位时间内,有3mol H-H生成的同时必定6md N-H断裂,不能说明反应达到平衡状态,错误;B.根据方程式,起始是N2和H2的物质的量之比等于化学计量数之比,反应过程中N2和H2的物质的量之比始终保持不变,不能说明反应达到平衡状态C.反应后,气体的物质的量减小,质量不变,因此达到平衡状态时,混合气体的平均相对分子质量变大,正确;D.达到平衡状态后,再充入2molNH3,相当于增大压强,平衡正向移动,重新达到平衡后,N2的体积分数变小 ,正确;故选CD;
(三)分析图象变化可知:在投料比一定时,曲线Ⅰ、Ⅱ、Ⅲ对应的氢气的转化率依次降低,因此压强依次减小,故P1>P2>P3;设起始量氢气为x,氮气物质的量为y;根据题意和图像,N2的转化率为50%,H2的转化率为60%,
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
yx
0.5y 0.6x
则0.5y:0.6x=1:3,解得![]() =
=![]() ,即X=
,即X=![]() ,故答案为:P1>P2>P3;
,故答案为:P1>P2>P3; ![]() ;
;
(四) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
反应 x 3x 2x
平衡 1-x 3-3x 2x
则![]() ×100%=20%,解得x=
×100%=20%,解得x=![]() mol,NH3的物质的量分数为
mol,NH3的物质的量分数为![]() ÷
÷![]() =20%,N2的物质的量分数为20%,H2的物质的量分数为60%, 平衡常数Kp=
=20%,N2的物质的量分数为20%,H2的物质的量分数为60%, 平衡常数Kp= ,故答案为:
,故答案为:  ;
;
(五)根据总反应:8NO+7H2O=3NH4NO3+2HNO3,阳极发生氧化反应,一氧化氮失去电子生成硝酸根离子,电极反应式为NO+2H2O-3e-=4H++NO3-,故答案为:NO+2H2O-3e-=4H++NO3-。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】光刻胶的一种合成路线如下:

己知:
I.
II.![]()
III.RCOOH+CH=CH→RCOOCH=CH2
请回答下列问题:
(1)A的名称是________________。C中所含官能团的名称是________________。
(2)C→D的反应类型是:________________,X的结构简式为________________。
(3)D+G→光刻胶的化学方程式为____________。
(4)T是C的同分异构体,T具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物。则T的结构有___________种,其中核磁共振氢谱为5组峰,且峰面积比为1:1:2:2:2的结构简式为__________________。
(5)根据自己已学知识并结合相关信息,写出以CH3CH2OH为原料制备(CH3CH2CH2COOH的合成路线流程图(无机试剂任选)。________________
(合成路线流程图示例:CH2 =CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) ![]() 2C(g);△H<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);△H<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
X | Y | |
A | 再加入A | B的百分含量 |
B | 再加入C | A的体积分数 |
C | 增大压强 | A的转化率 |
D | 升高高温度 | 混合气体平均摩尔质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏低的是
① 容量瓶用蒸馏水洗涤但没有干燥
② 定容时仰视刻度线
③ 没有洗涤溶解NaCl固体的烧杯和玻璃棒
④ 称量NaCl固体时所用砝码生锈了
A. ①③ B. ②③ C. ①②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚类化合物以其独特的化学结构使其拥有重要的生理活性,在农药、医药、化工、香料和染料等领域发挥着重要的作用。下图是合成“氮-苯甲酰基-2-甲基-3吲哚乙酸甲酯”的路线

已知: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
回答下列问题
(1)B的结构简式为________,B分子中含有的官能团为________(填官能团名称)。
(2)反应③为取代反应,该反应的化学方程式为________。
(3)C的名称为________。
(4)A的结构简式为________,反应⑤的反应类型为________。
(5)B有多种同分异构体,其中与B含有相同官能团的同分异构体有________种。
(6)已知
参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物体的化合物的描述,正确的是( )
A. 细胞中主要的化合物是有机物
B. 组成蛋白质的氨基酸种类有60多种
C. 淀粉通过胞吞进入动物细胞
D. 蓝细菌只含有DNA,而不含RNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是___________;仪器c的名称是________,反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_________。下列仪器中可用于分离苯乙酸粗品的是_____________(填标号)。A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是_________,最终得到44 g纯品,则苯乙酸的产率是__________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com