
����Ŀ�����������������صĻ�ѧ�ṹʹ��ӵ����Ҫ���������ԣ���ũҩ��ҽҩ�����������Ϻ�Ⱦ�ϵ���������Ҫ�����á���ͼ�Ǻϳɡ���-��������-2-��-3���������������·��

��֪: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
�ش���������
��1��B�Ľṹ��ʽΪ________��B�����к��еĹ�����Ϊ________������������ƣ���
��2����Ӧ��Ϊȡ����Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ________��
��3��C������Ϊ________��
��4��A�Ľṹ��ʽΪ________����Ӧ�ݵķ�Ӧ����Ϊ________��
��5��B�ж���ͬ���칹�壬������B������ͬ�����ŵ�ͬ���칹����________�֡�
��6����֪
���������ϳ�·�ߣ���![]() Ϊԭ�ϣ����Լ���ѡ��������Ʊ�
Ϊԭ�ϣ����Լ���ѡ��������Ʊ�![]() �ĺϳ�·��________��
�ĺϳ�·��________��
���𰸡� ![]() ̼̼˫�����Ȼ�
̼̼˫�����Ȼ�  �״�
�״�  ȡ����Ӧ 7 ��
ȡ����Ӧ 7 �� 
����������1��������֪��Ϣ��![]() ��
��![]() ��Ӧ����B��BΪ
��Ӧ����B��BΪ![]() �����к��еĹ�������̼̼˫�����Ȼ����ʴ�Ϊ��
�����к��еĹ�������̼̼˫�����Ȼ����ʴ�Ϊ��![]() ��̼̼˫�����Ȼ���
��̼̼˫�����Ȼ���
��2����Ӧ��Ϊȡ����Ӧ����Ӧ�Ļ�ѧ����ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3������![]() ��
��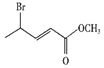 �ṹ�IJ�𣬷�����������Ӧ�����CΪ�״����ʴ�Ϊ���״���
�ṹ�IJ�𣬷�����������Ӧ�����CΪ�״����ʴ�Ϊ���״���
��4������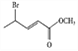 ��
�� �ṹ�IJ��AΪ
�ṹ�IJ��AΪ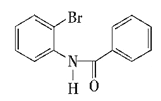 ����Ӧʱ��������
����Ӧʱ�������� �����������廯�⣬����ȡ����Ӧ���ʴ�Ϊ��
�����������廯�⣬����ȡ����Ӧ���ʴ�Ϊ�� ��ȡ����Ӧ��
��ȡ����Ӧ��
��5��BΪ![]() ��B�ж���ͬ���칹�壬������B������ͬ�����ŵ�ͬ���칹����CH2=CHCH2CH2COOH��CH3CH=CHCH2COOH��CH2=C��CH3��CH2COOH��CH2=CHCH��CH3��COOH��CH3CH=C��CH3��COOH��CH3C��CH3��=CHCOOH��CH2=C��CH2CH3��COOH����7�֣��ʴ�Ϊ��7��
��B�ж���ͬ���칹�壬������B������ͬ�����ŵ�ͬ���칹����CH2=CHCH2CH2COOH��CH3CH=CHCH2COOH��CH2=C��CH3��CH2COOH��CH2=CHCH��CH3��COOH��CH3CH=C��CH3��COOH��CH3C��CH3��=CHCOOH��CH2=C��CH2CH3��COOH����7�֣��ʴ�Ϊ��7��
��6����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �������ñ����������Ӧ�����屽���ٷ���������Ӧ����
�������ñ����������Ӧ�����屽���ٷ���������Ӧ����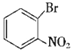 ��������
�������� ����������ԭ���ɣ��ϳ�·��Ϊ
����������ԭ���ɣ��ϳ�·��Ϊ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��Na ��CO2��Ӧ���ij��ѧ��ȤС�鰴��ͼװ�ý���ʵ�顣
��֪��CO + 2Ag ( NH3) 2OH=2Ag��+( NH4 ) 2CO3 +2NH3

�ش��������⣺
��1��д��A �з�Ӧ�����ӷ���ʽ__________________________��
��2������X ��������_____________��B �е���ҺΪ________________��
��3���ȳ���Ӳ�ʲ����ܵ�����Ϊm1 g ������Ʒװ��Ӳ�ʲ������У��Ƶ���Ʒ��Ӳ�ʲ����ܵ���������m2 g ���ٽ�������ʵ�����������ȷ˳����________�����ţ���
a����ȼ�ƾ��ƣ����� b��Ϩ��ƾ��� c���ر�K1��K2
d����K1��K2��ͨ��CO2��E �г��ֻ���
e������Ӳ�ʲ����� f����ȴ������
�ظ������������裬ֱ��Ӳ�ʲ����ܺ��أ��Ƶ�����Ϊm3 g ��
��4������Ӳ�ʲ�����һ��ʱ�䣬�۲쵽��������
�� �ƿ�����ڣ����ڳɽ���С��
�� �������ȣ���Ѹ��ȼ�գ�������ɫ���档��Ӧ��ȫ�����д�����ɫ���ʣ��� F ���Թ��ڱ����������ʲ�����
���������������ԭ����____________________________________��
��5��̽�����������Ԫ��Na �Ĵ�����ʽ
����һ��ֻ��Na2CO3���������ֻ��Na2O ����������Na2O��Na2CO3����
�������ʵ����ƣ���֤�������裺
���� | ���� | ���� |
1 | ��Ӳ�ʲ������еĹ����������ˮ����� | ����һ���� |
2 | ������1������Һ��___________________________ | |
3 | _____________________________________________ |
��6����������ʵ�������±�ʵ�����ݣ�д��Na ��CO2��Ӧ���ܻ�ѧ����ʽ___________��
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤����������ֵ������˵����ȷ���ǣ� ��
A. 12gʯī�к���C-C���ĸ���Ϊ1.5NA B. 60g SiO2�к���Si-O���ĸ���Ϊ2NA
C. 124 g P4�к�P-P���ĸ���Ϊ4 NA D. 12 g���ʯ�к�C-C���ĸ���ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Թ�ҵ�����е�CrԪ�ػ����������õĹ������£���֪�����ȡҺ�еĽ���������Ҫ��Cr3+�������������Fe2+��Fe3+��Al3+��Ca2+��Mg2+)��
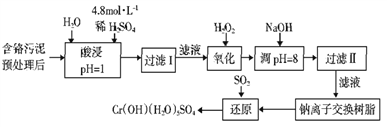
���������ӳ�����������������ʽ����ʱ��Һ��pH���±�:
������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
��ʼ����ʱ��pH | 1.9 | 7.0 | ���� | ���� | ���� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8 | 9��>9�ܽ⣩ |
��1��ʵ������98%���ܶ�Ϊ1.84g��cm-3)��Ũ��������200 mL 4.8 mol��L-1��������Һ������ʱ��Ҫ��ȡ98%��Ũ��������Ϊ_______ mL������С�����һλС���������õIJ����������ձ�������������Ͳ����ʽ�ζ����⣬����_______��
��2�����˲���ʱ����Ҫ�Գ�������ϴ�ӣ�ϴ�ӳ����ķ�����_______��
��3������H2O2������һ����������+3��Crʹ֮ת���+6��Cr��CrO42-��Cr2O72-�����Ա������������ӷ��룺��һ������_______�������ӷ���ʽ��ʾ��
��4��������Һ��pH=8��ȥ������������_______��
��5�������ӽ�����֬��ԭ��Ϊ��Mn++nNaR��MRn+nNa+��������������������_______��
��6��ͨSO2����ʱ����ԭ���̷������·�Ӧ����дȱ�����ʲ���ƽ����
____ Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⣺
��һ����֪�� H2O(g)=H2O(1) ��H=-44kJmol-1
��N2(g)+O2(g)![]() 2NO(g) ��H=+180.5kJmol-1
2NO(g) ��H=+180.5kJmol-1
��4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) ��H=+l025kJmol-1
4NH3(g)+5O2(g) ��H=+l025kJmol-1
д��NH3(g)��O2(g)��һ��������ת��ΪN2(g)��Һ̬ˮ���Ȼ�ѧ����ʽ_________
��������ҵ�ϳɰ���ԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g) ��H =-92.4kJmol-1���ϳ�ʱ��Ӧ�¶ȿ�����500�棬ѹǿ��2��l07~5��l07Pa������ý��������
2NH3(g) ��H =-92.4kJmol-1���ϳ�ʱ��Ӧ�¶ȿ�����500�棬ѹǿ��2��l07~5��l07Pa������ý��������
��1�����з�Ӧ�����Ŀ��Ʋ�������������ԭ�����͵���_________��
A����ʱ�����NH3
B��ʹ������ý������
C����Ӧ�¶ȿ�����500������
D����Ӧʱѹǿ������2��l07~5��l07Pa
��2��һ���¶��£���1molN2��3molH2����һ�㶨�ݻ����ܱ������з�Ӧ��һ��ʱ���Ӧ�ﵽƽ��״̬������˵������ȷ����________��
A����λʱ���ڣ���3mol H-H���ɵ�ͬʱ��6md N-H���ѣ�˵����Ӧ�ﵽƽ��״̬
B��N2��H2�����ʵ���֮�ȱ��ֲ���ʱ��˵����Ӧ�ﵽƽ��״̬
C���ﵽƽ��״̬ʱ����������ƽ����Է����������
D���ﵽƽ��״̬��,�ٳ���2molNH3�����´ﵽƽ���N2�����������С
��������ͼ��ʾH2��ת��������ʼͶ�ϱȣ�n(N2)��n(H2)����ѹǿ�ı仯��ϵ���������ߢ��Ӧ��ѹǿP1��P2��P3 �Ӹߵ��͵�˳����_________________�����B��X��60����ʱN2��ת����Ϊ50%����X=________��
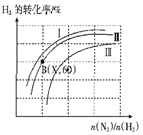
���ģ�һ���¶��£���lmolN2��3molH2����һ�ܱ������з�Ӧ�����ƽ��ʱ��������ѹΪP��NH3�����ʵ�������Ϊ20%����ʽ�������ʱ��ƽ�ⳣ��Kp=________����ƽ���ѹ����ƽ��Ũ�Ƚ��м��㣬��ѹ=��ѹ������������ɲ�����
���壩��NOԭ�ϣ�ͨ�����ķ��������Ʊ�NH4NO3�����ܷ�Ӧ��8NO+7H2O=3NH4NO3+2HNO3��д���Զ��Բ������缫��������Ӧʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ԫ����H2R��pKa1=1.85��pKa2=7.45����֪pKa=��lgKa�����ڴ��¶�����20mL0.1molL��1H2R��Һ�еμ�0.1molL��1��NaOH��Һ����Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ��
�����й�˵����ȷ���ǣ�������
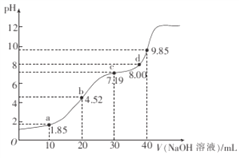
A. a����ʾ��Һ�У�c��H2R��+c��HR����+c��R2����=0.1molL��1
B. b����ʾ��Һ�У�c��Na+����c��HR������c��H2R����c��R2����
C. c����ʾ��Һ�У�c��Na+����3c��R2����
D. d����ʾ��Һ�У�c��Na+����c��R2������c��HR����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���������ó��Ľ��۴������
ѡ�� | ʵ�� | ���� | ���� |
A | ��KBrO3��Һ�м�����������Ȼ��ͨ������Cl2 | �л���ʳ�ɫ | �����ԣ�Cl2> KBrO3 |
B | ��KNO3��KOH�����Һ�м������۲����ȣ� ��ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ��Ϊ��ɫ | NO3-����ԭΪNH3 |
C | ��0.1 molL-1��Na2CO3��Һ�м������η�̪����Һ��dz��ɫ���� | ��ɫ���� | ����ˮ�������ȷ�Ӧ |
D | ��0. 1 mol L-1��MgSO4��Һ���뵽NaOH��Һ���������г����������ٵμ�0.1 molL-1��CuSO4��Һ | ��ɫ������Ϊ��ɫ���� | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ڿ�ѧ������ȷ����( )
A. ����ƷXX�ư˱��������ӡ����ۡ���Բ�Ⱦ��ƶ��ɣ��ʺ������ߣ����Բ�����
B. ���������ũ��ɽȪϵ����Ʒ������Ʒ���Բ����κλ�ѧ����
C. ��������ͣ�����ά����D�����������ı������������������ڹ�������
D. ���ֿڷ�Һ���зḻ��N��P��Zn����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼����Ϊ�ǼӾ�����ЧӦ����Ҫ���ʣ���Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��.�п�ѧ�����������FeO���պ�����CO2����ص��Ȼ�ѧ����ʽ���£�
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) �� ��H=-76.0 kJ��mol-1
��3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ��H=-18.7 kJ��mol-1
(1)��������Ӧ�Т��У�ÿ����1molCO2������_______molFeO��������
(2)��д��C(s)��ˮ������Ӧ����CO2��H2���Ȼ�ѧ����ʽ___________��
��.һ�������£�������̼ת��Ϊ���顣��һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ�ķ�ӦCO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ���ﵽƽ��ʱ�������ʵ�Ũ�ȷֱ�ΪCO2 0.2mol��L-1��CH4 0.8mol��L-1��H2 0.8mol��L-1��H2O 1.6mol��L-1��
CH4(g)+2H2O(g) ���ﵽƽ��ʱ�������ʵ�Ũ�ȷֱ�ΪCO2 0.2mol��L-1��CH4 0.8mol��L-1��H2 0.8mol��L-1��H2O 1.6mol��L-1��
(3)��300���ǣ��������ʰ�������ʼŨ��(mol��L-1)����÷�Ӧ�����У��ﵽƽ������Ũ������������������ƽ��Ũ����ͬ����_____________��
ѡ�� | CO | H2 | CH4 | H2O |
A | 0 | 0 | 1 | 2 |
B | 2 | 8 | 0 | 0 |
C | 1 | 4 | 1 | .2 |
D | 0.5 | 2 | 0.5 | 1 |
(4)�������¶Ȳ��䣬����������ڳ�������ʼ����ȵ�CO2��H2�����´ﵽƽ��ʱ��CH4��Ũ
��________(����ĸ)��
A.c(CH4)=0.8mol��L-1 B.0.8mol L-1 >c(CH4) >1.6mol L-1
C.c(CH4)=l.6mol��L-1 D.C(CH4)>1.6mol L-1
(5)��300ʱ�������������м���CO20.8 mol��L-1��H21.0 mol��L-1��CH4 2.8 mol��L-1��H2O 2.0mol��L-1����ÿ��淴Ӧ��ʼ����v��_____v�� (�>�� ��<��)��
(6)����֪200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8 ��÷�Ӧ�ġ�H_________0(�>����<��)��
��.ij��У���о���Ա�о���һ�ַ�������ʵ��ˮ������ʱCO2���ŷţ������ԭ����ͼ��ʾ

(7)������ⷴӦ���¶�С��900��ʱ���У�̼����ȷֽ�ΪCaO��CO2�������Ϊ���ں�̼��ƣ������ĵ缫��ӦʽΪ3CO2+4e- =C+2CO32-���������ĵ缫��ӦʽΪ______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com