
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏低的是
① 容量瓶用蒸馏水洗涤但没有干燥
② 定容时仰视刻度线
③ 没有洗涤溶解NaCl固体的烧杯和玻璃棒
④ 称量NaCl固体时所用砝码生锈了
A. ①③ B. ②③ C. ①②③ D. 全部
科目:高中化学 来源: 题型:
【题目】下列操作不影响测定1mol氢气体积的实验结果的是
A.操作中漏气
B.镁带称量后,用砂皮擦去表面氧化层
C.硫酸稍过量
D.读取液体量瓶的体积读数作为氢气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O22-代替(如图),晶体中含有的哑铃形O22-使晶胞沿一个方向拉长。下列对于KO2晶体结构的描述正确的是( )

A. 与K+距离最近且相等的O2-共有4个 B. KO2的熔点比RbO2的熔点低
C. 与K+距离最近且相等的K+有12个 D. 一个KO2晶胞的质量为284 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 12g石墨中含有C-C键的个数为1.5NA B. 60g SiO2中含有Si-O键的个数为2NA
C. 124 g P4中含P-P键的个数为4 NA D. 12 g金刚石中含C-C键的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
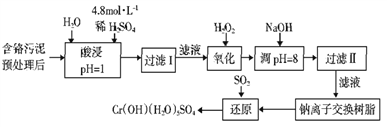
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_______ mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需_______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是_______。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是_______。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是_______。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是_______。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____ Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJmol-1
2NO(g) △H=+180.5kJmol-1
③4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) △H=+l025kJmol-1
4NH3(g)+5O2(g) △H=+l025kJmol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJmol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
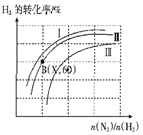
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3 从高到低的顺序是_________________;测得B(X,60)点时N2的转化率为50%,则X=________。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2> KBrO3 |
B | 向KNO3和KOH混合溶液中加入铝粉并加热, 将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
C | 向0.1 molL-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
D | 将0. 1 mol L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1 molL-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。关于这两种晶体的说法正确的是


A.两种晶体均为原子晶体
B.立方相氮化硼含有σ键和π键,所以硬度大
C.六方相氮化硼层结构与石墨相似却不导电的原因是层状结构中没有自由移动的电子
D.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1mol NH4BF4含有1 mol配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com