
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
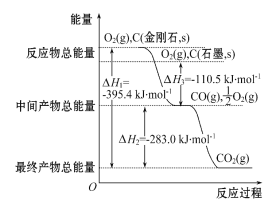
①在通常状况下,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH= ____________。
②12 g石墨在24 g氧气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为________kJ·mol-1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:_________________________。
【答案】ACD 石墨 -393.5 kJ·mol-1 252.0 kJ 631.5 2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1
【解析】
(1)开源节流指的是开发新的能源,节约现有的化石能源;
A、大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源,开发了新的能源,能够节约化石燃料,A符合题意;
B、化石能源的使用会增加温室效应气体的排放,不利于环保和节约能源,B不符合题意;
C、开放新能源,减少化石能源的使用,C符合题意;
D、资源的重复使用,可以节约能源,D符合题意;
ACD符合题意;
(2) ①根据图示,石墨(s)+O2(g)的能量比金刚石(s)+O2(g)的能量低,则石墨的能量低于金刚石的能量;能量越低,越稳定,则石墨更稳定;根据图示,石墨的燃烧热为 △H3+△H4=-110.5kJ·mol-1+(-283. 0kJ·mol-1)=-393.5 kJ·mol-1;
②12g石墨完全燃烧生成CO2,需要32gO2,现只有24gO2,因此36g气体为CO和CO2的混合气体,设CO的物质的量为x,根据C守恒,CO2的物质的量为(1-x)mol,则根据质量守恒,有28x+44(1-x)=36,得x=0.5mol,则该石墨燃烧,生成了0.5molCO和0.5molCO2,生成0.5molCO,放出的热量为0.5×110.5kJ=55.25kJ;生成0.5molCO2,放出的热量为0.5×393.5kJ=196.75kJ;则总热量为55.25kJ+196.75kJ=252kJ;
(3)化学反应中,断开键需要吸热,形成键需要放热,假设NO分子中化学键的键能为E(NO),则有ΔH=946 kJ·mol-1+497 kJ·mol-1-2E(NO)= +180.0 kJ·mol-1,可得E(NO)= 631.5 kJ·mol-1;
(4)根据图示CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1(为反应①)
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1(为反应①)
N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1(为反应②);
将(反应①×2-反应②)可得NO和CO的反应方程式,则ΔH =-283.0 kJ·mol-1×2-
(+180.0 kJ·mol-1)= -746.0 kJ·mol-1,,则CO和NO反应的热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
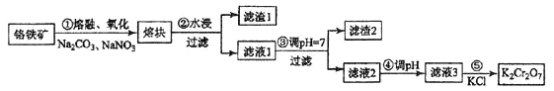
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;

(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___(填试剂名称)。
②用 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。

①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________(填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___;写出其中CO与NO完全转化为无害气体的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K=2.25,该温度下,在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如表所示,下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2(mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2)是0.08mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
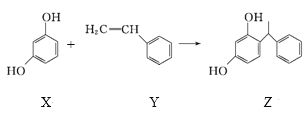
下列叙述错误的是( )
A.X、Y和Z均能使溴水褪色
B.X和Z均能与NaHCO3溶液反应放出CO2
C.Y既能发生取代反应,也能发生加成反应
D.Y可作加聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一固定体积的密闭容器中发生反应:A(s)+3B(g)![]() 2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
①混合气体的压强不再变化
②单位时间内生成2a mol C,同时生成3a mol B
③气体密度不再变化
④A的质量不再变化
⑤气体的平均相对分子质量不再变化
⑥2v逆(C)=3v正(B)
A.①③B.②⑤C.①⑥D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.银氨溶液的配制:在洁净的试管中加入2%AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止
B.丙醛在催化剂存在下与氢气反应是还原反应,甲醛与新制的Cu(OH)2发生的是氧化反应
C.为了鉴别己烯、甲苯和丙醛,可以使用新制Cu(OH)2悬浊液与溴水
D.乙醇的球棍模型为:![]() ,分子式为CH3CH2OH
,分子式为CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
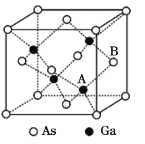
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____(填“大于”或“小于”,下同)As,第一电离能B____Ga;BF3和NH3的分子能够通过配位键相结合的原因是____。
(3)杀虫剂Na3AsO4中阴离子的空间构型为____,As原子采取____杂化。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为____;该晶体的密度为______g/cm3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com