
【题目】(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl—、NO3—、CO32—中不同的阴、阳离子所组成。经实验A溶液、B溶液均可与盐酸反应,其中A 产生白色沉淀,B产生气泡。则A为 、B为 、将B和C的溶液混合反应的化学方程式为: 。
(Ⅱ)一学生设计了如下实验方案分离NaCl和CaCl2两种固体的混合物。填空和回答下列问题:

(1)B物质是 (写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,此杂质的化学式为 ,因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)写出生成沉淀B的化学方程式 。
(4)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。
【答案】
(Ⅰ)AgNO3;Na2CO3;BaCl2+Na2CO3=BaCO3↓+2NaCl
(Ⅱ)(1)Ca CO3;
(2)Na2CO3;向滤液中滴加过量稀盐酸后蒸发结晶
(3)CaCl2+ Na2CO3= CaCO3↓+2NaCl
(4)固体混合物A
【解析】
试题分析:(Ⅰ)A、B、C为三种无色可溶盐,则Ag+只能结合NO3-形成AgNO3、剩下的离子中Ba2+只能结合Cl-形成BaCl2,另一种物质则为Na2CO3;A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,则A为AgNO3;B与盐酸产生气泡,所以B为Na2CO3,C不与盐酸反应,则C为BaCl2,将B和C的溶液混合反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,故答案为:AgNO3;Na2CO3;BaCl2+Na2CO3=BaCO3↓+2NaCl;
(Ⅱ)(1)NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,过滤后得到的沉淀B为碳酸钙,故答案为:CaCO3;
(2)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,向滤液中加入适量盐酸至不产生气体,生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠,故答案为:Na2CO3;先加入过量盐酸后再蒸发结晶;
(3)钙离子与碳酸根反应生成碳酸钙沉淀,离子方程式:Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(4)要测定该样品中NaCl和CaCl2的质量比,可称量干燥的碳酸钙的质量,根据反应CaCO3+2H+=Ca2++CO2↑+H2O可计算氯化钙的质量,混合物A的总质量减去氯化钙的质量可得氯化钠的质量,故答案为:混合物A。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液的工艺流程如下:
(1)“沉淀”中生成CuI的离子方程式为___________________。

(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_____________,分析原因_________________。
(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是________________,反应Ⅱ的化学方程式是_________________________。
(4)操作Ⅰ包括____________,冰水洗涤的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石英是制造光导纤维的原料,也是常用的半导体材料
B. 氧化铝是冶炼金属铝的原料,也是较好的耐火材料
C. 天然氨基酸能溶于强碱或强酸溶液,是两性化合物
D. 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲烷的燃烧热为890.3 kJmol-1。氢气的燃烧热为285.8 kJmol-1。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2 kJ,则该混合气体中甲烷和氢气的物质的量比为( )
A.1∶8
B.8∶1
C.4∶17
D.17∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的叙述错误的是( )
A.化学反应均伴随着能量的变化
B.物质的化学能可以在一定条件下转化为热能、电能,为人类利用
C.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值
D.需要加热才能发生的反应不一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的最外层上只有2个电子,该元素是()
A. 一定是IIA元素
B. 一定是金属元素
C. 一定是正二价元素
D. 可能是金属元素,也可能是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: 。
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3。pH调节的范围是 ,试剂X可以选用 (填选项字母)。
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3·H2O
(4)电解(Ⅴ)中阳极的电极反应式为 。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
B.向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO2-4
C.在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加
D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
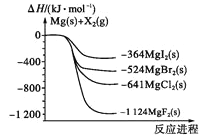
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2<MgBr2<MgCl2<MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com