
����Ŀ��ij�����������̿�(��MnO2������Al2O3)����п��(��ZnS������FeS)��������Zn��MnO2���䲿�������������£�

��֪������(��)������Һ��MnSO4��ZnSO4��Fe2(SO4)3��Al2(SO4)3�Ļ��Һ����ؽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0 mol��L��1����)���±���
������ | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
��ʼ����ʱ��pH | 2.7 | 4.0 | 6.4 | 7.7 |
��ȫ����ʱ��pH | 3.7 | 5.2 | 8.0 | 10.4 |
��1�����ȡ���ȡʱ���ӿ�ʯ������飬��Ŀ���� ��
��2��д��FeS��MnO2��ϡ���ᷴӦ�����ӷ���ʽ�� ��
��3���Լ�X�������ǵ�����Һ��pH������Fe(OH)3��Al(OH)3��pH���ڵķ�Χ�� ���Լ�X����ѡ�� (��ѡ����ĸ)��
A��MnCO3 B��Na2CO3 C��Zn2(OH)2CO3 D��NH3��H2O
��4�����(��)�������ĵ缫��ӦʽΪ ��
��5��Zn��MnO2��������ص�ԭ�ϡ�ijп���̼��Ե����KOH��ҺΪ�������Һ�������ܷ�ӦʽΪ��Zn(s)��2MnO2(s)��H2O(l)��Zn(OH)2(s)��Mn2O3(s)���õ�ص������ĵ缫��ӦʽΪ ��
���𰸡���1���ӿ췴Ӧ����ȡ������
��2��2FeS��3MnO2��12H+��2Fe3+��2S����3Mn2+��6H2O
��3��5.2��6.4 AC
��4��Mn2+��2H2O��2e����MnO2��4H+
��5��2MnO2��H2O��2e����Mn2O3��2OH��
��������
�����������1�����ȡ���ȡʱ���ӿ�ʯ������飬��Ŀ���Ǽӿ췴Ӧ���ʣ���2������ԭ���غ㡢�����غ�ɵ���ƽ�Ļ�ѧ����ʽ��2FeS��3MnO2��12H+��2Fe3+��2S����3Mn2+��6H2O����3���Լ�X�������ǵ�����Һ��pH������Fe(OH)3��Al(OH)3��Ҫʹ![]() ��
��![]() ��ȫ��������
��ȫ��������![]() ��
��![]() ���ܳ�����pH���ڵķ�Χ��5.2��6.4���Լ�X�����������ʣ��Լ�X����ѡ��MnCO3 ��Zn2(OH)2CO3����4�����(��)����п�Ͷ������̣�������������������Ӧ�������ĵ缫��ӦʽΪMn2+��2H2O��2e����MnO2��4H+����5��ԭ�������������ԭ��Ӧ�������ܷ�ӦʽMnO2������ԭ��Ӧ����Mn2O3����ص������ĵ缫��ӦʽΪ2MnO2��H2O��2e����Mn2O3��2OH����
���ܳ�����pH���ڵķ�Χ��5.2��6.4���Լ�X�����������ʣ��Լ�X����ѡ��MnCO3 ��Zn2(OH)2CO3����4�����(��)����п�Ͷ������̣�������������������Ӧ�������ĵ缫��ӦʽΪMn2+��2H2O��2e����MnO2��4H+����5��ԭ�������������ԭ��Ӧ�������ܷ�ӦʽMnO2������ԭ��Ӧ����Mn2O3����ص������ĵ缫��ӦʽΪ2MnO2��H2O��2e����Mn2O3��2OH����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����nAΪ�����ӵ�������ֵ������������ȷ���ǣ� ��
A�����³�ѹ�£�16g14CH4����������ĿΪ8nA
B����״���£�22��4 LCCl4����������ĿΪnA
C��1 L 0��5 mol��L-1��CH3COONa��Һ��������CH3COO-������ĿΪ0��5n
D��6��2g���ף�����ʽΪP4�����ӽṹ����ͼ��ʾ������P-P����ĿΪ0�� 3nA

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡�����Ԫ�ؾ�λ�ڶ����ڣ�X��W��������֮��Ϊ23������˵����ȷ����
![]()
A. YԪ�ص�����������ˮ�����Ǻ�������������ǿ��
B. W��Rֻ���γ�һ�ֻ�����WR3����Ϊ����������
C. X����ۺ����������ļ���̬�⻯���������ԭ��Ӧ
D. Z��R�γɵĻ�����ZR2������������Ʒ�Ļ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(��)A��B��C������ɫ�������ηֱ�����Na+��Ag+��Ba2+��Cl����NO3����CO32���в�ͬ����������������ɡ���ʵ��A��Һ��B��Һ���������ᷴӦ������A ������ɫ������B�������ݡ���AΪ ��BΪ ����B��C����Һ��Ϸ�Ӧ�Ļ�ѧ����ʽΪ�� ��
(��)һѧ�����������ʵ�鷽������NaCl��CaCl2���ֹ���Ļ�����պͻش��������⣺

��1��B������ (д��ѧʽ)
��2������ʵ�鷽������õ���NaCl���������������ʣ������ʵĻ�ѧʽΪ ����Ϊ����������ijһ�������ë������һ������ȷ��Ʒ���Ӧ�� ��
��3��д�����ɳ���B�Ļ�ѧ����ʽ ��
��4����Ҫ�ⶨ����Ʒ��NaCl��CaCl2�������ȣ��ɳ��������B���ʺ���һ���ʵ����������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ��ֽ�ڼ����Һʱ����Ҫʪ���������ʱ����ʪ��
B. ��ɫ��Ӧʹ�õIJ�˿ͨ������ϡ������ϴ
C. ��ˮ�еĵ�����þƾ���ȡ
D. ��ʵ�����������ˣ���ˮϴ������ϡNaOH��Һ��ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��S2O32-+2H+= SO2��+S��+H2O��̽����ѧ��Ӧ���ʵ�Ӱ�����أ�����ʵ����dz������������
��� | �¶�/�� | 0.1 mol��L-1 Na2S2O3/mL | 0,1 mol��L-1 H2SO4/mL | ˮ/mL |
A | 30 | 10 | 10 | 0 |
B | 30 | 5 | 5 | 10 |
C | 25 | 10 | 5 | 5 |
D | 25 | 5 | 10 | 5 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L���ܱ������У�X��Y��Z����Ϊ���壩�������ʵ�����ʱ��ı仯������ͼ��ʾ��
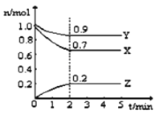
��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ����ʼ��2��������Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)= ��
��3��2min��Ӧ��ƽ�������ڻ�������ƽ����Է�����������ʼʱ ��������С��������������ܶȱ���ʼʱ ��������С�䣩��
��4�����д�ʩ�ܼӿ췴Ӧ���ʵ��� ��
A������ʱ����X B����ʱ�����Z C�������¶� D��ѡ���Ч�Ĵ���
��5������˵����ȷ���� ��
A�������¶ȿ��Ըı仯ѧ��Ӧ��ƽ��״̬
B����֪����Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ�������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C���ﵽ��ѧ��Ӧ��ƽ��״̬��ʱ�䳤����
D����ѧ��Ӧ��ƽ��״̬�Dz����ܸı��
E������Y��Ũ�ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�������������ӵ�X��Y��Z��W����Ԫ��ԭ��������С��36�� Y��̬ԭ�����������������ڲ����������3����X��W��̬ԭ����ͬ����Ԫ����δ�ɶԵ���������ԭ�ӣ�X��Z��ԭ�Ӻ���������֮�͵���Wԭ�Ӻ�����������Z��̬ԭ��ֻ��1��δ�ɶԵĵ��ӡ�
�ش��������⣺
��1����֪������XZ3��H2Y��Y���⻯�������Ӧ�Ļ�ѧ����ʽΪXZ3��H2Y��XH3��HZY����Ԫ�صĵ縺�ԣ�Y Z����������������С��������������HZY���ӵĿռ乹��Ϊ ��
��2��X��һ���⻯�����Է�������Ϊ32��1mol���⻯���е��������� �����⻯����ˮ�е��ܽ�����Σ���Ҫԭ����ʲô��
��3��Ԫ��Y 3��ԭ���γɵĵ��ʷ�����Ԫ��X��Y�γɵ�һ�����ӻ�Ϊ�ȵ����壬�������ӵĻ�ѧʽ�� ��
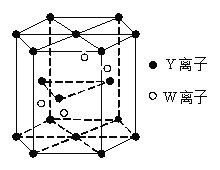
��4����̬Wԭ�ӵĵ����Ų�ʽ�� ��Ԫ��Y��W��һ�ֻ�����ľ���ṹ����ͼ��ʾ���þ���Ļ�ѧʽΪ ����W���ھ����ڲ���Y�ֱ��ھ������ġ����㡢���ڲ���
��5������ԭ�� ��ѡ������������þ������ͭ�����γɵľ���Ķѻ���ʽ��������������Y���ӵĶѻ���ʽ��ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д���������ǣ� ��
A��H+��Na+��CO32��
B��Cl����Ba2+��SO42��
C��Fe3+��OH����SO42��
D��H+��Ag+��NO3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com