
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、 Fe3+、 Al3+、 Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是____(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8gCr2O72-转移4.8 mol e-,该反应离子方程式为________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处 理含Cr2O72-的废水。
实验室用如图装置模拟处理含Cr2O72-废水,阳极反应是Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。

(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”), 理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________。
(4)若溶液中初始含有0.lmol Cr2O72-,则生成的阳离子全部转化成沉淀的质量是_____g。
【答案】A AB CD 3S2O32-+4Cr2O72-+13H2O==6SO42-+8Cr (OH)3↓+2OH- 不能 因阳极产生的 Cu2+不能使Cr2O72-还原到低价态 Cr2O72-+6Fe2++14H+== 2Cr3++6Fe3++7H2O 水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O![]() H++ OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全 84.8
H++ OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全 84.8
【解析】
某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、 Fe3+、 Al3+、 Ca2+和Mg2+等,加H2O2的目的是把Fe2+氧化为Fe3+,同时Cr3+被氧化成Cr2O72-,再加NaOH调节pH得到Cr(OH)(H2O)5SO4.
(1) 加氧化剂的是把Fe2+氧化为Fe3+,同时Cr3+被氧化成Cr2O72-,不能引入新杂质,所以可用Na2O2代替H2O2。答案:A。
(2)加入NaOH溶液调整溶液PH,当pH=8时,Fe3+、 Al3+都转化为氢氧化物沉淀被除去。已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是Ca2+ 和.Mg2+。所以答案: AB 、 CD。
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-,则反应的离子方程式为:3S2O32-+4Cr2O72-+13H2O==6SO42-+8Cr (OH)3↓+2OH-。
(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,故答案为:不能;因阳极产生的 Cu2+不能使Cr2O72-还原到低价态。
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O。
(3)因为水中的H+在阴极区放电,所以H+浓度减小促使水的电离平衡H2O![]() H++ OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全。答案_水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O
H++ OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全。答案_水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O![]() H++ OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全。
H++ OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全。
(4)由6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O知若溶液中初始含有0.lmol Cr2O72-,则生成的阳离子Fe3+、Cr3+全部转化成沉淀为Fe(OH)3和 Cr(OH)3,他们的质量是0.6mol![]() 107g/mol+0.2
107g/mol+0.2![]() 103g/mol=84.8g,答案:84.8。
103g/mol=84.8g,答案:84.8。


科目:高中化学 来源: 题型:
【题目】I.某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。
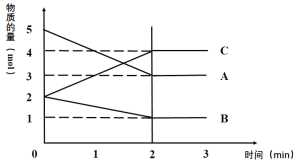
(1)该反应的化学方程式为__________________。
(2)反应开始至2分钟时,B的平均反应速率为______________。
(3)能说明该反应已达到平衡状态的是_________。
A.υ(A)=2υ(B) B.容器内气体密度不变 C.υ逆(A)=υ正(C)
D.各组分的物质的量相等 E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为________。
II.已知甲烷燃烧的化学反应方程式为CH4+2O2![]() CO2+2H2O,若以4mol/L 500mL KOH(aq)为电解质溶液,将其设计为原电池,则
CO2+2H2O,若以4mol/L 500mL KOH(aq)为电解质溶液,将其设计为原电池,则
(1)其正极电极方程式为___________。
(2)至某时刻溶液中c(CO32-)=1mol/L,则导线上通过的电子的物质的量为_____,此时消耗标准状况下CH4体积_____ L 。(假设化学能全部转化为电能;溶液体积保持不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制0.2 mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称量的NaCl的质量分别是( )
A.1000 mL,l1.7gB.950mL,11.1 gC.500mL,11.7gD.100mL,11.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.Na2O2、Fe2O3、Al2O3均为碱性氧化物B.稀豆浆、硅酸溶胶、CuSO4溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质D.盐酸、水玻璃、漂白液均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A.MnO4-,K+,Na+,NO3-B.Na+,K+,HCO3-,Cl-
C.Ba2+,K+,S2-,SO42-D.Na+,NH4+,Cl-,SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①![]() 和
和![]() ②红磷和白磷 ③
②红磷和白磷 ③![]() 和
和![]() ④
④![]() 和
和![]() ⑤
⑤![]() 和
和![]() ⑥
⑥ 和
和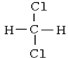
(1)属于同素异形体的是________(2)互为同位素的是________
(3)互为同分异构体的是________(4)属于同系物的是________
(5)属于同种物质的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中的可逆反应 2HI(g) ![]() I2(g) +H2(g) ,能说明反应达到平衡的是
I2(g) +H2(g) ,能说明反应达到平衡的是
A. 反应容器内压强不随时间变化而变化
B. 单位时间内消耗2moHI,同时生成1moH2
C. HI的浓度与I2的浓度相等
D. 混合气体的颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯酮的结构简式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到。下列说法不正确的是
A. 1mol乙烯酮与1molH2完全反应生成1mol乙醇
B. 乙烯酮中所有的原子均处于同一平面内
C. 乙烯酮与水反应生成乙酸的反应属于加成反应
D. 乙烯酮与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是___________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______>______;比较g、h的最高价氧化物对应水化物的酸性强弱:_______。
(3)写出一种既含离子键又含极性共价键e的氧化物的电子式:_____。
(4)已知1 gX的单质在足量d2中燃烧,恢复至室温,放出142.9kJ热量,写出表示其燃烧热的热化学方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com