
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是___________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______>______;比较g、h的最高价氧化物对应水化物的酸性强弱:_______。
(3)写出一种既含离子键又含极性共价键e的氧化物的电子式:_____。
(4)已知1 gX的单质在足量d2中燃烧,恢复至室温,放出142.9kJ热量,写出表示其燃烧热的热化学方程式:____。
【答案】第三周期ⅢA族 O2- Na+ HClO4>H2SO4 ![]() H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol
【解析】
从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此分析作答。
(1)f是Al元素,其原子序数为13,在元素周期表中位于第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径: O2->Na+;非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,故答案为:第三周期、第ⅢA族;O2-;Na+;HClO4>H2SO4;
(3)Na与O结合,既含离子键又含极性共价键,则该化合物为Na2O2,其电子式为:![]() ;
;
(4)常温下,氢气在氧气中燃烧生成液态水,1 g氢气的物质的量为![]() =0.5mol,则1mol氢气燃烧放出的热量为142.9 kJ×2=285.8 kJ,故其燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol。
=0.5mol,则1mol氢气燃烧放出的热量为142.9 kJ×2=285.8 kJ,故其燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol。


科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、 Fe3+、 Al3+、 Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是____(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8gCr2O72-转移4.8 mol e-,该反应离子方程式为________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处 理含Cr2O72-的废水。
实验室用如图装置模拟处理含Cr2O72-废水,阳极反应是Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。

(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”), 理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________。
(4)若溶液中初始含有0.lmol Cr2O72-,则生成的阳离子全部转化成沉淀的质量是_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途正确且具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.金属钠具有还原性,可从硫酸铜溶液中置换出铜
D.Al2O3熔点高,可用作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种元素,A在地壳中含量最高的元素,B是金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C在第三周期第一电离能最小;D在第三周期中第一电离能最大。下列有关叙述不正确的是
A. 四种元素A、B、C、D分别为:O、Ca、Na、Ar
B. 元素A、B、C两两组成的化合物可为:CaO、CaO2、Na2O、Na2O2等
C. 元素A、C简单离子的半径大小关系为:A<C
D. 元素B、C的第一电离能:B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
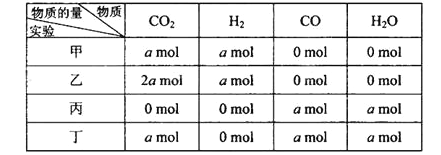
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A. 乙=丁>丙=甲 B. 乙>丁>甲>丙
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式___________________________________,写出基态24Cr原子的价电子排布式________________________;
(2)写出基态N的原子核外电子排布图:__________________;
(3)若将基态14Si的电子排布式写成1s22s22p63s33p1,则它违背了_______________________;
(4)Fe3+比Fe2+的稳定性更________(填“强”或“弱”),从结构上分析原因是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式_____.
②在X极附近观察到的现象是_____.检验Y电极反应产物的方法是_____.
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为_____;电子的流向由_____到_____(填X或Y).②Y电极的材料是_____,电极反应式为_____.CuSO4溶液的浓度_____(填“不变”“略有增加”或“略有减少”).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______。
A. N2和H2在一定条件下反应生成NH3
B. 雷雨闪电时空气中的N2和O2化合生成NO
C. NH3经过催化氧化生成NO
D. NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。

(7) 收集氨气应使用________法,要得到干燥的氨气可选用_________做干燥剂。

(8)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(9)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(10)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com