
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
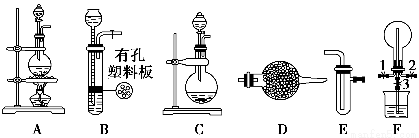
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子__________________________________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________________________________。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
(1)D ad
(2)饱和食盐水、浓硫酸
(3)氯气 取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成],证明固体中有NH4+
(4)装置E中的NaBr溶液变橙红色
(5)CH2=CH2+Br2―→Br—CH2—CH2—Br
(6)SO2+2H2S=3S↓+2H2O 吸收尾气
【解析】(1)制取NH3,可用浓氨水的分解制备,然后再用碱石灰或生石灰干燥,但不能用CaCl2,因为CaCl2可结合NH3生成CaCl2·8NH3。(2)制取干燥纯净的Cl2,可用饱和食盐水除HCl,再用浓H2SO4干燥Cl2。(3)应向烧瓶中先通Cl2,再通NH3,因为Cl2有颜色,便于观察;一开始若通NH3,由于弹簧夹3打开,容易形成喷泉。证明NH要注意“操作→现象→结论”,同时还要注意细节,如浓NaOH,加热,湿润等。(4)可利用Cl2+2NaBr=2NaCl+Br2,证明还原性Br->Cl-。(5)CH2=CH2+Br2―→CH2BrCH2Br。(6)SO2+2H2S=3S↓+2H2O;F可用来吸收剩余的SO2或H2S。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2014年高二人教版化学选修五 2-1-1脂肪烃 烷烃和烯烃练习卷(解析版) 题型:填空题
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3—CH=CH—CH2—CH=CH2―→CH3CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH―→CH3COOH+HOOCCH2COOH+HCOOH
某烃分子式为C10H10,在臭氧作用下发生反应:
C10H10―→CH3COOH+3HOOC—CHO+CH3CHO
(1)C10H10分子中含有________个双键,________个三键
(2)C10H10分子结构简式为________。
查看答案和解析>>
科目:高中化学 来源:2014年高二人教版化学选修五 1-2有机化合物的结构特点练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.28 g C2H4所含共用电子对数目为4NA
B.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA
C.1 mol甲烷分子所含质子数为10NA
D.标准状况下,22.4 L乙醇的分子数为NA
查看答案和解析>>
科目:高中化学 来源:2014年高二人教化学选修五2-1-2脂肪烃炔烃脂肪烃来源及应用练习卷(解析版) 题型:填空题
实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。

(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
查看答案和解析>>
科目:高中化学 来源:2014年高二人教化学选修五2-1-2脂肪烃炔烃脂肪烃来源及应用练习卷(解析版) 题型:选择题
某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是( )
A.混合气体中一定没有乙炔
B.混合气体中一定有乙烯
C.混合气体可能由乙炔和丙烯组成
D.混合气体一定由乙烯和乙炔组成
查看答案和解析>>
科目:高中化学 来源:2014年高中化学创新训练上专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是( )。
选项实验事实结论
A将SO2通入含HClO的溶液中生成H2SO4HClO的酸性比H2SO4强
B铝箔在酒精灯火焰上加热熔化但不滴落铝箔表面氧化铝熔点高于铝
CSiO2可以和NaOH溶液及HF溶液反应SiO2属于两性氧化性
D将SO2通入溴水中,溴水褪色SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题9常见金属元素及其重要化合物练习卷(解析版) 题型:填空题
明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下:
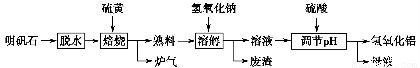
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ______↑。
______↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,红磷)+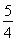 O2(g)=
O2(g)=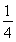 P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com