
����Ŀ�����ǻ��õļ����Ԫ�أ��Ƽ��仯�������������������й㷺��Ӧ�á�
��1����������(NaN3)��ײ����ȫ�ֽ�����ƺ͵������ʿ�Ӧ����������ȫ���ҡ������� 6.72 L(��״����)������������Ҫ��������_____g��
��2��Ϊʵ�ֽ������ڸ���������������ˮ��Ӧ���ռ����ɵ����壬ij�о� ��ѧϰС���������ͼ����װ�ã�
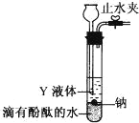
��д�� Na ��ˮ��Ӧ�����ӷ���ʽ_____��
��Y Һ�����ѡ��_____
A��ú�� B���ƾ� C�����Ȼ�̼
��ʵ��ǰ�����װ�������Եķ����ǣ��ر�ֹˮ�У�ͨ��_________����װ�����ƣ����Թ��м�ˮ������Һ��һ��ʱ���_____�������������������á�
��3��1mol ���������� 1.6mol ̼�����ƹ����Ϻ����ܱյ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ������ʼ���Ӧ�����ʵ���(�ɲ�����)��
���� | ���ʵ���/mol |
__________ | __________ |
__________ | __________ |
���𰸡�13 g 2Na+2H2O=2Na++2OH-+H2 A ����©�� Һ���� Na2CO3 1.6 NaOH 0.4
��������
(1)������Ӧ��2NaN3=2Na+3N2�������ݷ���ʽ���㣻
(2)�� Na ��ˮ��Ӧ����NaOH��������
�ڸ���װ�ÿ�֪YҺ���ܶ�С��ˮ������ˮ���ܣ�
������Һѹ��ȷ��װ�������ԣ�
(3)���ȷ���2NaHCO3![]() Na2CO3+CO2��+H2O��Ȼ����2Na2O2+2CO2�T2Na2CO3+O2��2Na2O2+2H2O�T4NaOH+O2�����Դ������
Na2CO3+CO2��+H2O��Ȼ����2Na2O2+2CO2�T2Na2CO3+O2��2Na2O2+2H2O�T4NaOH+O2�����Դ������
(1)����ҪNaN3 ������Ϊm����
2NaN3![]() 2Na+3N2��
2Na+3N2��
130g 67.2L
m 6.72L
m=![]() =13g��
=13g��
(2)�� Na ��ˮ��Ӧ����NaOH�����������ӷ���ʽΪ2Na+2H2O=2Na++2OH-+H2����
��װ�ÿ�֪YҺ���ܶ�С��ˮ������ˮ���ܣ�
A��ú���ܶ�С��ˮ������ˮ���ܣ���A��ȷ��
B���ƾ���ˮ���ܣ���B����
C�����Ȼ�̼�ܶȴ���ˮ������ˮ���ܣ���C����
�ʴ�ΪA��
��ʵ��ǰ�����װ�������Եķ����ǣ��ر�ֹˮ�У���©����עˮ��ֱ������©���е�Һ������Թ��е�Һ�棬������Һ���ٸı䣬��֤����װ�����������ã�
(3)��2NaHCO3![]() Na2CO3+CO2��+H2O��֪��1.6mol̼�����Ʒֽ�����0.8molNa2CO3��0.8molCO2��0.8molH2O����2Na2O2+2CO2�T2Na2CO3+O2��֪��0.8molCO2��0.8molNa2O2��Ӧ����0.8molNa2CO3��2Na2O2+2H2O�T4NaOH+O2����0.2molNa2O2��ˮ��Ӧ����0.4molNaOH����ַ�Ӧ���ų��������ʺ���ȴ��������Ĺ���������NaOH��Na2CO3�����ߵ����ʵ����ֱ�Ϊ0.4mol��1.6mol��
Na2CO3+CO2��+H2O��֪��1.6mol̼�����Ʒֽ�����0.8molNa2CO3��0.8molCO2��0.8molH2O����2Na2O2+2CO2�T2Na2CO3+O2��֪��0.8molCO2��0.8molNa2O2��Ӧ����0.8molNa2CO3��2Na2O2+2H2O�T4NaOH+O2����0.2molNa2O2��ˮ��Ӧ����0.4molNaOH����ַ�Ӧ���ų��������ʺ���ȴ��������Ĺ���������NaOH��Na2CO3�����ߵ����ʵ����ֱ�Ϊ0.4mol��1.6mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ����0.50 mol��L��1 NaOH��Һ480 mL�������в������������ʵ������֣���ʹ��������������
��1��ѡ����������ɱ�ʵ��������������У�������ƽ(��ȷ��0.1 g)��ҩ�ס��ձ�����������________��________��
��2�����㡣���Ƹ���Һ���ȡNaOH���������Ϊ________g��
��3��������
��4���ܽ⡢��ȴ��
��5��ת�ơ�ϴ�ӡ�
��ʹ������ƿǰ����________________������ƿ��ע������⣬������_______��ѡ���ţ���
a.�¶� b.Ũ�� c.ѹǿ d.�̶��ߣ�
����ת��ʱӦʹ�ò�����������ϴ���ձ�2��3����Ϊ��_________________________��
��6�����ݣ�ҡ�ȡ�
��7������ȷ���������������Һ���ʵ���Ũ��Ϊ0.192mol/L,ԭ�������___________��
A.ʹ����ֽ����NaOH���壻
B.�ܽ�NaOH����ձ�δ�����ϴ�ӣ�
C.����ƿ��ԭ������������ˮ��
D.����ʱ���õ��������⣻
E.δ��ȴֱ��ת��������ƿ��������ã�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��������������ij�������Ƹ﹤ҵ������Cr(III)�Ĵ���������������:

��֪:�������ȡҺ�еĽ���������Ҫ��Cr3+�������Fe2+��Al3+��Ca2+��Mg2+����Cr2O72-+H2O![]() 2CrO42-+2H+���۳����£�����������������������ʽ����ʱ��Һ��pH����:
2CrO42-+2H+���۳����£�����������������������ʽ����ʱ��Һ��pH����:
������ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
������ȫʱ��pH | 3.2 | 11.1 | 5.4(>8�ܽ�) | 9(>9�ܽ�) |
(1) ʵ������18.4mol/L��Ũ��������480mL2mol/L�����ᣬ����ȡŨ����_____mL������ʱ����Ͳ���ձ��Ͳ������⣬�����õ��IJ���������______________��
(2) H2O2�������ǽ���ҺI�е�Cr3+ת��ΪCr2O72-,д���˷�Ӧ�����ӷ���ʽ:__________��
(3����II�����õ���������ҪΪ______(�ѧʽ),��ҺII�к��е�������Ҫ��__��
(4) �����ӽ�����֬�ķ�Ӧԭ��Ϊ:Mn++nNaR=MRn+nNa+,�����������ӽ�����֬�ɳ�ȥ��ҺII�еĽ�����������_______________��
(5) д��������������SO2���л�ԭʱ������Ӧ�����ӷ���ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ٺ͢�Ϊ���������ͬ�Ĺ̶�������ͼ�С����͡�![]() ���ֱ��ʾ��ԭ�Ӻ���ԭ�ӣ�������˵����ȷ����
���ֱ��ʾ��ԭ�Ӻ���ԭ�ӣ�������˵����ȷ����
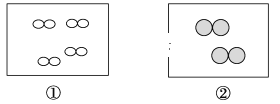
A.�����е�H2Ϊ1 mol�������������������Ϊ3.01��1023��
B.�ٺ͢������������֮��Ϊ1��4
C.H2��O2���ܷ������Ϸ�Ӧ�������ܷ����û���Ӧ
D.���������¶Ⱥ�ѹǿ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������������ʵ�ʵ��̽�����������ͼʵ��װ�����Ʊ�����֤����������(���ּг�װ��δ����)����ش�������⣺
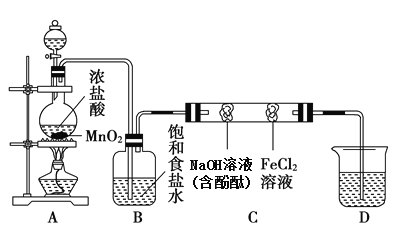
��1��A�з��ù���������̵�װ��������_________��
��2���Ʊ�ʵ�鿪ʼʱ���ȼ��װ�������ԣ���μ������װ�õ������ԣ�_____________________________________________________________��
��3�������װ�õ������Ժ������IJ���������________(�����)��
A.����ƿ�м���MnO2��ĩ B.���� C.����ƿ�м���Ũ����
��4��д��A�з�Ӧ�Ļ�ѧ����ʽ________________________________��
��5��װ��B��������______________________________________________��
��6��Ӳ�ʲ�����C������װ������պ������Լ���������������ʵ������Ϊ________________�������������ԭ������ǣ� _______________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����й�������;�����ʵ���������ȷ�����������ϵ���ǣ� ��
ѡ�� | ��; | ���� |
A | �ƼغϽ�����ԭ�ӷ�Ӧ�ѵĵ��ȼ� | �ƻ�ѧ���ʺܻ��� |
B | KI�����������ӵ��� | I�����л�ԭ�ԣ��ױ�����ΪI2 |
C | 84����Һ���ڻ������� | NaClO��H2O��CO2��Ӧ����HClO |
D | Na2CO3����ʳƷ���ɼ� | Na2CO3�����ܲ������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ȷ����![]()
A. ʵ��������ɫ����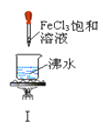
B. ʵ�����Һ��ɫ���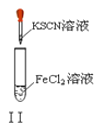
C. ʵ��ų���������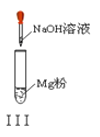
D. ʵ������ȳ��ְ�ɫ���������ܽ�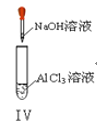
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A��C��H��O����Ԫ����ɣ���Է�������Ϊ90����9.0 g A ��ȫȼ�յIJ�������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����5.4 g��13.2 g��A����NaHCO3��Һ������Ӧ����2����A֮����ˮ��������Ԫ��������й�A��˵����ȷ����
A. ����ʽ��C3H8O3
B. 0.1 mol A������Na��Ӧ����2.24 L H2����״����
C. A�������IJ����ܷ���������Ӧ
D. A��һ�������·������۷�Ӧ�IJ�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.24 L��NaCl��MgCl2��CaCl2��ɵĻ��Һ�У���������Ũ�ȴ�С��ͼ��ʾ���ش��������⡣
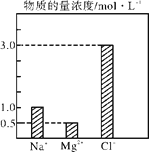
��1���û��Һ�У�NaCl�����ʵ���Ϊ______mol��������MgCl2������Ϊ________g��
��2���û��Һ��CaCl2�����ʵ���Ϊ________mol�����û��Һ��ˮϡ�������Ϊ1200mL��ϡ�ͺ���Һ��Ca2�������ʵ���Ũ��Ϊ______mol��L��1��
��3�����ϡ�ͺ����Һ�м������������ữ����������Һ���ɵõ�����________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com