
【题目】如图所示,①和②为两个体积相同的固定容器,图中“”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是
”分别表示氢原子和氧原子,则下列说法正确的是
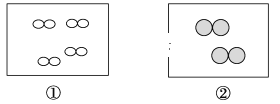
A.若①中的H2为1 mol,则②中所含分子总数为3.01×1023个
B.①和②中气体的质量之比为1∶4
C.H2、O2均能发生化合反应,但不能发生置换反应
D.两容器的温度和压强均相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】燃烧![]() 某有机物,得到
某有机物,得到![]() 和
和![]() ,由此可得出结论是
,由此可得出结论是![]()
![]()
A. 该有机物含有2个碳原子和6个氢原子
B. 该有机物中碳元素和氢元素的原子个数比为3:1
C. 该有机物中含有2个![]() 和3个
和3个![]()
D. 该有机物的1个分子里含有2个碳原子和6个氢原子,可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是

A. 气体A是NO2
B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42-
C. 溶液E和气体F不能发生化学反应
D. X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上时就会造成人畜中毒,请回答:
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式___________。
(2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4 ,当吸收2.2molPH3转移电子______mol
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式______。
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______.
②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为________.
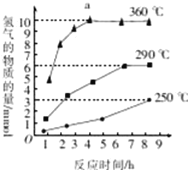
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有____(填含硫微粒的离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1mol·L-1元酸HA溶液中,不断滴加1mol·L-1的NaOH溶液所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Kα(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究物质时会涉及物质的组成、分类、性质和用途等方面。
①Na2O2属于____________(填物质的类别),检验其组成中所含阳离子的方法是_____________。
②将包有少量____色Na2O2固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,观察到的现象是__________________,由此得出的结论是_________________________________。
③在潜水艇和消防员的呼吸面具中,Na2O2所发生反应的化学方程式为_________________________,从氧化剂和还原剂的角度分析,在该反应中Na2O2的作用是___________________。某潜水艇上有25人,如果每人每分钟消耗的O2在标准状况下体积为0.80L(标准状况下O2的密度为1.429g/L),假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需要的Na2O2的物质的量是_____________。
(2)写出下列反应的离子方程式:
①NaHCO3溶于醋酸:__________________________________________________。
②过量CO2与NaOH溶液:_____________________________________________。
③工业制漂白液:______________________________________________________。
④生活中漂白粉的漂白原理:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生 6.72 L(标准状况下)氮气,至少需要叠氮化钠_____g。
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究 性学习小组设计了如图发生装置.
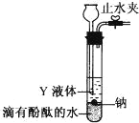
①写出 Na 与水反应的离子方程式_____。
②Y 液体可以选用_____
A.煤油 B.酒精 C.四氯化碳
③实验前检验该装置气密性的方法是:关闭止水夹,通过_________(填装置名称)向试管中加水至产生液面差,一段时间后,_____(填现象),则气密性良好。
(3)1mol 过氧化钠与 1.6mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质及对应的物质的量(可不填满)。
物质 | 物质的量/mol |
__________ | __________ |
__________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
B. 7.8 g Na2O2中含有的阴离子数目为0.2NA
C. 将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA
D. 23 g Na 与足量H2O反应完全后可生成NA个H2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com