
【题目】下表中有关物质用途、性质的叙述均正确,且有因果关系的是( )
选项 | 用途 | 性质 |
A | 钠钾合金用作原子反应堆的导热剂 | 钠化学性质很活泼 |
B | KI可用于制作加碘盐 | I﹣具有还原性,易被氧化为I2 |
C | 84消毒液用于环境消毒 | NaClO与H2O、CO2反应生成HClO |
D | Na2CO3用作食品膨松剂 | Na2CO3遇酸能产生气体 |
A.AB.BC.CD.D
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】(1)15.6g Na2X中含Na+ 0.4mol,则Na2X的摩尔质量是____________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是_________________(用含NA的式子表示)。
(3)标况下,密度为1.25g/L的CO2与CH4组成的混合气体中,CO2的体积分数为______。
(4)下列各项与胶体性质无关的有______________________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上时就会造成人畜中毒,请回答:
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式___________。
(2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4 ,当吸收2.2molPH3转移电子______mol
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式______。
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______.
②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为________.
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有____(填含硫微粒的离子符号)。
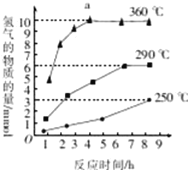
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究物质时会涉及物质的组成、分类、性质和用途等方面。
①Na2O2属于____________(填物质的类别),检验其组成中所含阳离子的方法是_____________。
②将包有少量____色Na2O2固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,观察到的现象是__________________,由此得出的结论是_________________________________。
③在潜水艇和消防员的呼吸面具中,Na2O2所发生反应的化学方程式为_________________________,从氧化剂和还原剂的角度分析,在该反应中Na2O2的作用是___________________。某潜水艇上有25人,如果每人每分钟消耗的O2在标准状况下体积为0.80L(标准状况下O2的密度为1.429g/L),假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需要的Na2O2的物质的量是_____________。
(2)写出下列反应的离子方程式:
①NaHCO3溶于醋酸:__________________________________________________。
②过量CO2与NaOH溶液:_____________________________________________。
③工业制漂白液:______________________________________________________。
④生活中漂白粉的漂白原理:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生 6.72 L(标准状况下)氮气,至少需要叠氮化钠_____g。
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究 性学习小组设计了如图发生装置.
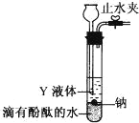
①写出 Na 与水反应的离子方程式_____。
②Y 液体可以选用_____
A.煤油 B.酒精 C.四氯化碳
③实验前检验该装置气密性的方法是:关闭止水夹,通过_________(填装置名称)向试管中加水至产生液面差,一段时间后,_____(填现象),则气密性良好。
(3)1mol 过氧化钠与 1.6mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质及对应的物质的量(可不填满)。
物质 | 物质的量/mol |
__________ | __________ |
__________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 甲苯既可使溴的四氯化碳溶液因反应而褪色,也可使酸性高锰酸钾溶液褪色
B. 有机物![]() 的消去产物有两种
的消去产物有两种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH—COOCH3
D. 可用溴水鉴别苯、四氯化碳和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.1mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL。下列叙述正确的是( )
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(SO42-)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)<c(Al3+)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)>c(Ba2+)
D. x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com