
【题目】在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。
【答案】① ② ② ③ ①<②<④<③
【解析】
根据n= ![]() =
= ![]() =
= ![]() ,ρ=
,ρ=![]() 进行计算。
进行计算。
①在标准状况下, 44.8LH2的物质的量为n=![]() =2mol,所含分子数为2NA,一个氢气分子有2个电子,则2mol氢气含有电子数为2 mol×2×NA =4NA,H2体积为44.8L,2mol氢气的质量=nM=2×2g/mol=4g,密度ρ=
=2mol,所含分子数为2NA,一个氢气分子有2个电子,则2mol氢气含有电子数为2 mol×2×NA =4NA,H2体积为44.8L,2mol氢气的质量=nM=2×2g/mol=4g,密度ρ=![]() 0.089g/L;
0.089g/L;
② 24gCH4的物质的量为n=![]() =1.5mol,分子数为1.5mol ×NA =1.5NA,一个CH4分子含有10个电子,则24g CH4中含电子数为1.5NA×10=15NA, V=nVm=1.5mol×22.4L/mol=33.6L,ρ=
=1.5mol,分子数为1.5mol ×NA =1.5NA,一个CH4分子含有10个电子,则24g CH4中含电子数为1.5NA×10=15NA, V=nVm=1.5mol×22.4L/mol=33.6L,ρ=![]() 0.714g/L;
0.714g/L;
③1molH2O的物质的量为1mol,所含电子数为NA,一个水分子中含有10个电子,1molH2O中电子数为1 mol×10 ×NA =10NA;质量m=nM=1mol×18g/mol =18g;标况下水是固液混合物,其余都是气体,固体的体积最小,密度是103g/L;
④3.01×1023个O2的物质的量为![]() =0.5mol,则氧气分子数为0.5NA,一个氧气分子中含有16个电子,则0.5NA个氧气分子中电子数为0.5×16×NA=8NA;质量为m=nM=0.5 mol×32g/mol=16g;体积为V=nVm=0.5mol×22.4L/mol=11.2L,ρ=
=0.5mol,则氧气分子数为0.5NA,一个氧气分子中含有16个电子,则0.5NA个氧气分子中电子数为0.5×16×NA=8NA;质量为m=nM=0.5 mol×32g/mol=16g;体积为V=nVm=0.5mol×22.4L/mol=11.2L,ρ=![]() 1.429g/L;
1.429g/L;
故含分子数最多的是①;含电子数最多的是②;质量最大的是②;体积最小的是③;密度由小到大的顺序为 ①<②<④<③;
故答案为:①;②;②;③; ①<②<④<③。


科目:高中化学 来源: 题型:
【题目】下表中有关物质用途、性质的叙述均正确,且有因果关系的是( )
选项 | 用途 | 性质 |
A | 钠钾合金用作原子反应堆的导热剂 | 钠化学性质很活泼 |
B | KI可用于制作加碘盐 | I﹣具有还原性,易被氧化为I2 |
C | 84消毒液用于环境消毒 | NaClO与H2O、CO2反应生成HClO |
D | Na2CO3用作食品膨松剂 | Na2CO3遇酸能产生气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种“绿色试剂”,可作为矿业废液处理剂。如要消除采矿业废液中的氰化物(KCN),化学方程式为:KCN+H2O2+H2O=X+NH3↑。
(1)生成物X的化学式为_________________。
(2)已知:上述反应中,N元素化合价不发生变化,则KCN中C元素的化合价为_____;该反应的氧化剂是_______(填化学式)。
(3)双氧水作为“绿色试剂”的原因是____________________________________。
(4)在标准状况下有448L氨气生成时,转移的电子数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。填写下列空白:

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):____________________________。
(2)B中NaOH溶液的作用是____________________。
(3)试管C中苯的作用是_______________________。
反应开始后,观察D和E两试管,看到的现象为____________________________,此现象可以验证苯和液溴的反应为____________(填反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
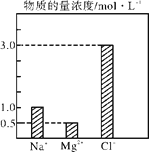
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL 5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A. Fe2O3B. Fe3O4C. Fe4O5D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg和Al形成的合金m g 完全溶于足量的盐酸中,得到标准状况下H2的体积为2.24L。现向反应后的溶液中加入足量的氨水,过滤、洗涤并充分灼烧得到n g 固体,则n 值为
A. m + 3.4B. m + 1.6C. ![]() D. 无法计算
D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓盐酸所贴标签截图如下图所示,现用该浓盐酸配制250mL浓度为1mol/L的稀盐酸。试回答下列问题:

(1)该浓盐酸的浓度为_____________;
(2)经计算,宜选用下列中______(填字母)的量筒,量取_____(填计算结果)mL浓盐酸。
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶颈刻度线下1~2 cm处,改用胶头滴管加蒸馏水,使溶液的凹液面最低处与刻度线相切。
③在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶中。
上述操作中,正确的顺序是(填序号)___________________。
(4)在实际配制溶液的过程中,难免由于操作不当或操作错误而对所配溶液浓度产生影响,请分析下列情况对本实验所配制稀盐酸浓度的影响(填“偏高”、“偏低”或“无影响”):
①定容时俯视刻度线,会导致所配稀盐酸浓度_______;
②用刚刚洗涤干净的量筒来量取浓盐酸,会导致所配稀盐酸浓度__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制95mL 1mol·L-1的稀硫酸。
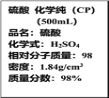
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,除玻璃棒外还缺少的仪器是__(写仪器名称);
(2)经计算,配制95mL 1mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL,量取硫酸时应选用___mL规格的量筒(填序号);
A.10mL B.50mL C.100mL D.200mL
(3)取25mL 1mol·L-1的硫酸,向其中加入一定量的氧化铜,充分反应后制得硫酸铜溶液。用该溶液制取CuSO4·5H2O,所需要的主要玻璃仪器除酒精灯、玻璃棒外,还缺少的仪器是___;
(4)对所配制的稀硫酸进行测定,发现其浓度大于1mol·L-1,配制过程中下列各项操作可能引起该误差的原因___(填序号)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com