
【题目】将Mg和Al形成的合金m g 完全溶于足量的盐酸中,得到标准状况下H2的体积为2.24L。现向反应后的溶液中加入足量的氨水,过滤、洗涤并充分灼烧得到n g 固体,则n 值为
A. m + 3.4B. m + 1.6C. ![]() D. 无法计算
D. 无法计算
【答案】B
【解析】
n(H2)=![]() =0.1 mol,Mg、Al合金分别和足量稀盐酸反应生成氯化物和氢气,氯化镁、氯化铝和足量氨水反应分别生成Mg(OH)2、Al(OH)3沉淀,所以最后得到的沉淀是氢氧化镁和氢氧化铝的混合物,一个电子带一个单位负电荷、一个氢氧根离子带一个单位负电荷,所以镁铝合金失去电子的物质的量与生成氢氧化物需要氢氧根离子的物质的量相等,根据转移电子相等知,镁铝失电子物质的量=0.1 mol×2=0.2 mol,则沉淀中n(OH-)=0.2 mol,0.2mol OH-可以看做0.1molO和0.1molH2O,过滤、洗涤并充分灼烧得到n g 固体,固体的质量=合金的质量m+O的质量,则固体质量n=m(合金)+m(O)=mg+0.1mol×16g/mol=(m + 1.6)g,故选B。
=0.1 mol,Mg、Al合金分别和足量稀盐酸反应生成氯化物和氢气,氯化镁、氯化铝和足量氨水反应分别生成Mg(OH)2、Al(OH)3沉淀,所以最后得到的沉淀是氢氧化镁和氢氧化铝的混合物,一个电子带一个单位负电荷、一个氢氧根离子带一个单位负电荷,所以镁铝合金失去电子的物质的量与生成氢氧化物需要氢氧根离子的物质的量相等,根据转移电子相等知,镁铝失电子物质的量=0.1 mol×2=0.2 mol,则沉淀中n(OH-)=0.2 mol,0.2mol OH-可以看做0.1molO和0.1molH2O,过滤、洗涤并充分灼烧得到n g 固体,固体的质量=合金的质量m+O的质量,则固体质量n=m(合金)+m(O)=mg+0.1mol×16g/mol=(m + 1.6)g,故选B。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
B. 7.8 g Na2O2中含有的阴离子数目为0.2NA
C. 将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA
D. 23 g Na 与足量H2O反应完全后可生成NA个H2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是
A.含有NA个N的N2在标准状况下的体积约为22.4L
B.在常温常压下,11.2LCO2含有的分子数为0.5NA
C.标准状况下,11.2L氟化氢(沸点为19.54℃)中含有氟原子的数目为0.5 NA
D.3.2gO2和O3的混合物,所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬合金具有高硬度、耐腐蚀特性,广泛应用于精密仪器制造。由高碳铬铁合金废料粉末制取铬的简单流程如下:
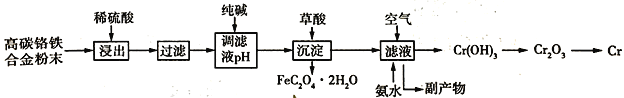
已知:Cr + H2SO4 = CrSO4 + H2↑
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有______________(合理、一条即可)
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是_________________,副产物直接排放环境不仅浪费,还污染水质。请你写出副产物的一个用途______________(合理给分)。
(3)加入草酸(H2C2O4)发生的离子方程式为__________________,铬属于难熔金属,写出工业中冶炼铬的化学方程式_________________。
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为_________________。
(5)已知高碳铬铁废料中铁铬元素质量之比为14:13。上述流程中铁元素转化为草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁晶体(FeC2O42H2O)的质量为18.00 t ,则可以冶炼铬的质量为________t(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
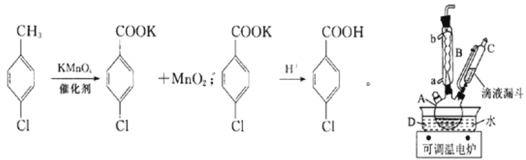
【题目】实验室中制备对氯苯甲酸的反应以及装置如图所示:
常温下,物质的有关数据和性质如表所示:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的仪器A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却,然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量。
请回答下列问题:
(1)仪器A的名称为______________________。
(2)仪器B是冷凝管,其起到的主要作用是:________________,实验过程中,冷却水从________口。
(3)实验过程中两次过滤、洗涤操作,第一次过滤的滤渣成分为___________(填化学式),洗涤该滤渣用热水,目的是_________________________________,第二次过滤后,洗涤滤渣用冷水,目的是______________________。
(4)过滤、洗涤操作中能用到的仪器是___________(填选项字母)。
a.烧杯 b.分液漏斗 c.锥形瓶 d.玻璃棒
(5)第一次过滤后的滤液中加入硫酸,出现的现象是___________。
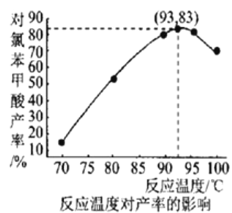
(6)如图是温度对对氯苯甲酸产率的影响关系,最后干燥、称量得到的对氯苯甲酸的质量为___________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2 和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250-300℃时,温度升高而乙酸的生成速率降低的主要原因是因为催化剂的催化效率降低
C. 由300-400℃可得,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大。
D. 根据图像推测,工业上若用上述反应制备乙酸最适宜的温度应为400℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com