
【题目】双氧水是一种“绿色试剂”,可作为矿业废液处理剂。如要消除采矿业废液中的氰化物(KCN),化学方程式为:KCN+H2O2+H2O=X+NH3↑。
(1)生成物X的化学式为_________________。
(2)已知:上述反应中,N元素化合价不发生变化,则KCN中C元素的化合价为_____;该反应的氧化剂是_______(填化学式)。
(3)双氧水作为“绿色试剂”的原因是____________________________________。
(4)在标准状况下有448L氨气生成时,转移的电子数为___________________。
【答案】KHCO3 +2 H2O2 双氧水本身无毒,其氧化产物或还原产物均为无毒物质 40NA
【解析】
(1)根据质量守恒定律来分析A的化学式;
(2)元素的化合价降低时被还原作为氧化剂;
(3)根据还原产物为水来分析;
(4)根据化合价的变化来计算转移的电子数。
(1)由质量守恒定律可知,反应前后的元素守恒、原子个数守恒,则A的化学式为KHCO3;
(2)已知:上述反应中,N元素化合价不发生变化,则KCN中K为+1价,N为-3价,则根据化合物中各元素化合价代数和为0知,C元素的化合价为+2价;元素的化合价降低时被还原作为氧化剂,该反应的氧化剂是H2O2;
(3)该氧化还原反应中还原产物为水,对环境无污染,则H2O2被称为绿色氧化剂,故答案为:双氧水本身无毒,其氧化产物或还原产物均为无毒物质;
(4)标准状况下有448L氨气生成,氨气的物质的量为![]() =20mol,C元素由+2升高为+4,则转移的电子数为20mol×(4-2)=40mol,故答案为:40NA。
=20mol,C元素由+2升高为+4,则转移的电子数为20mol×(4-2)=40mol,故答案为:40NA。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上时就会造成人畜中毒,请回答:
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式___________。
(2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4 ,当吸收2.2molPH3转移电子______mol
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式______。
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______.
②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为________.
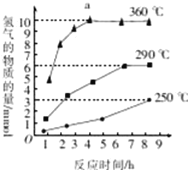
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有____(填含硫微粒的离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.1mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL。下列叙述正确的是( )
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(SO42-)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)<c(Al3+)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)>c(Ba2+)
D. x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M为海洋天然产物——PavidolideB不对称全合成的中间体之一,结构简式如下图。下列有关M的说法不正确的是

A. 分子式为C10H14O
B. 可发生加成反应、聚合反应
C. 分子中所有碳原子都在同一平面上
D. 苯环上连有-OH和-C4H9的M的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和研究乙炔性质的实验装置图,有关说法正确的是( )
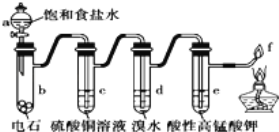
A. 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净
B. c(过量)的作用是除去影响后续实验的杂质
C. d、e褪色原理相同
D. f处产生明亮的蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
B. 7.8 g Na2O2中含有的阴离子数目为0.2NA
C. 将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA
D. 23 g Na 与足量H2O反应完全后可生成NA个H2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com