
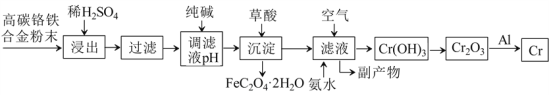
����Ŀ�����Ͻ�����Ҫ����;�������������ȡ������������:
��֪: �� Cr+H2SO4=CrSO4+H2����
�� �����и�Ԫ�ؽ���֮��������Cr(OH)3֮����������ƶ�����״̬��������Һ�С�
��ش���������:
��1��ϡ������������У���������������Ĵ�ʩ�У�________________________ (дһ������) ��
��2���ô��������ҺpH���õ�ij������������������������ܵ��µĺ����_��_____________��
��3�������е��������������������������Ա����ж��ⶾ�������ʵĻ�ѧʽ��___________�����������ʵ����ʵĻ�ѧʽ��_____________��
��4���������ʵ�ֳ���ת����Ӧ��ѧ����ʽΪ��_______________________________________��
��5���������������ȷ�Ӧұ�����Ļ�ѧ����ʽΪ��_____________________________________��
��6������������Һ����Cr(OH)3�Ļ�ѧ����ʽΪ��_____________________________________��
��7������֪��Ӧ��֮�⣬�����������漰����Ҫ������ԭ��Ӧ��_____�����ֽⷴӦ��____����
���𰸡����ȡ����衢�ʵ����ϡ����Ũ�ȵ�(�𰸺�������) H2C2O4������������ʹCr2+ת���ɳ�������ģ� Na2SO4 (NH4)2SO4 Fe(OH)2+H2C2O4=FeC2O4��2H2O Cr2O3+2Al![]() Al2O3+2Cr 4CrSO4+O2+8NH3��H2O+2H2O=4Cr(OH)3��+4(NH4)2SO4 3 1
Al2O3+2Cr 4CrSO4+O2+8NH3��H2O+2H2O=4Cr(OH)3��+4(NH4)2SO4 3 1
��������
��̼�����Ͻ��ĩ����ϡH2SO4��ȡ������Cr��Fe�ܽ�����CrSO4��FeSO4�����˺��ô������pHʹFe2+ת����Fe��OH��2�������ټ�����ὫFe��OH��2ת��ΪFeC2O4��2H2O��������ȥ����ʱ��Һ����Ҫ��CrSO4��Na2SO4������Һ��ͨ����������백ˮ����Һ��Cr2+ת����Cr��OH��3�����������ķ�ӦΪ4CrSO4+O2+8NH3��H2O+2H2O��4Cr��OH��3��+4��NH4��2SO4���õ��ĸ�������Ҫ����NH4��2SO4��Na2SO4��Cr��OH��3���ȷֽ��Cr2O3��Cr2O3��Al�������ȷ�Ӧ����Cr��Al2O3���ݴ˷�������
��1��������������Է�Ӧ���ʵ�Ӱ���֪ϡH2SO4��������У���ߡ������ʡ��Ĵ�ʩ�У����ȡ����衢�ʵ����ϡH2SO4��Ũ�ȵȡ�
��2���ô��������ҺpH��ʹFe2+ת����Fe��OH��2�������ټ�����ὫFe��OH��2ת��ΪFeC2O4��2H2O��������ȥ����������������ܵ��µĺ���ǣ�һ����ʹCr2+ת���ɳ����������ģ�ʹCr�IJ��ʽ��ͣ���һ����ʹ����������H2C2O4������������
��3����ȥFe2+�����Һ����Ҫ����ΪCrSO4��Na2SO4������Һ��ͨ����������백ˮ����Һ��Cr2+ת����Cr��OH��3�������õ��ĸ�����Ϊ��NH4��2SO4��Na2SO4�����п����������Ա����ж��ⶾ�������ʵĻ�ѧʽ��Na2SO4���ⶾ��ԭ��ΪSO42-+Ba2+=BaSO4�������������ʵ����ʵĻ�ѧʽ�ǣ�NH4��2SO4����NH4��2SO4��һ�ֵ��ʡ�
��4��������ὫFe��OH��2����ת��ΪFeC2O4��2H2O������ת����Ӧ�Ļ�ѧ����ʽΪFe��OH��2+H2C2O4��FeC2O4��2H2O��
��5��Al��Cr2O3�������ȷ�Ӧ����Al2O3��Cr����Ӧ�Ļ�ѧ����ʽΪ2Al+Cr2O3![]() Al2O3+2Cr������Һ��ͨ����������백ˮCrSO4ת��ΪCr��OH��3������1molCr2+ʧȥ1mol��������1molCr��OH��3��1molO2�õ�4mol���ӣ����ݵ�ʧ�����غ㡢ԭ���غ㣬����Һ����Cr��OH��3�Ļ�ѧ����ʽΪ4CrSO4+O2+8NH3��H2O+2H2O��4Cr��OH��3��+4��NH4��2SO4��
Al2O3+2Cr������Һ��ͨ����������백ˮCrSO4ת��ΪCr��OH��3������1molCr2+ʧȥ1mol��������1molCr��OH��3��1molO2�õ�4mol���ӣ����ݵ�ʧ�����غ㡢ԭ���غ㣬����Һ����Cr��OH��3�Ļ�ѧ����ʽΪ4CrSO4+O2+8NH3��H2O+2H2O��4Cr��OH��3��+4��NH4��2SO4��
��6������Ӧ��֮�⣬�����������漰����Ҫ������ԭ��Ӧ���У�Fe+H2SO4��FeSO4+H2����4CrSO4+O2+8NH3��H2O+2H2O��4Cr��OH��3��+4��NH4��2SO4��2Al+Cr2O3![]() Al2O3+2Cr����������ԭ��Ӧ��3�����ֽⷴӦΪ2Cr��OH��3
Al2O3+2Cr����������ԭ��Ӧ��3�����ֽⷴӦΪ2Cr��OH��3![]() Cr2O3+3H2O�����ֽⷴӦ��1����
Cr2O3+3H2O�����ֽⷴӦ��1����


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳƷ���Ӽ�������Ӧ��ȷ��һ����
A.��ɫ���������ܲ���B.��ζ������С�մ�
C.����������ɽ�����D.Ӫ��ǿ����������������ʳƷ�м���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ںڻ�ҩ����________�������á�
��2����������ȷֽ�Ļ�ѧ��Ӧ����ʽΪ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪HCO3��+AlO2��+H2O�TCO32��+Al��OH��3������������KHCO3��Һ���ϵ��뺬�����ʵ�����KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ���������KHCO3��Һ����Ĺ�ϵ�ɱ�ʾΪ�� ��
A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ϡ������ͭ��Ӧ�Ʊ�NO���壬�������ͼ��װ��(��ƿ�ڼ���ϡ�����ͭƬ����Ҫʱ�ɼ���)��ʵ��Ч������ʮ�����룬��Ϊ�۲쵽������������֤����Ӧ������NO�����������ͼ��װ��(��Ƥ���¶�����ͭ˿Ȧ)����������ʵ����Դﵽ�����Ч����
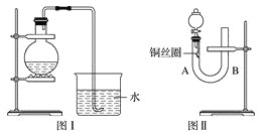
(1)��ͼ��װ����ʵ��ʱ������ˮ���ռ������������ɫΪ_____ɫ��ʵ�����������______�����۲쵽____________���ɣ��Ӷ���������֤����Ӧ������NO��
(2)��ͼ��װ����ʵ��ʱ�����йز���������ȫ��
�ٽ���Һ©���Ļ�������U�ιܵ�B��ܿ�ע��ϡ���ᣬһֱע��____________Ϊֹ��
�ڹرջ������þƾ�����U�ιܵ�A����ȣ���______ʱ��������ȥ�ƾ��ơ�
(3)����ͼ��װ�õ�ʵ������������⣺
�ٷ�Ӧ��ʲô����¿����Զ�ֹͣ��________________________��
���ںδ��۲쵽��ɫ��NO���壿____________________________________________��
���������Һ©���Ļ����������������۲쵽��Щ��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����ʾ��ͼ���������� ��
A | B | C | D |
����������ͨ�뵽һ������ˮ�� | ��NaHCO3��Һ���뵽һ����Ba(OH)2��Һ�� | ��ͭ�ۼ��뵽һ����Ũ������ | �����ۼ��뵽һ�����Ȼ�����Һ�� |
|
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ36.5%��Ũ����(�ܶ�Ϊ1.16 g��cm��3)���Ƴ�1 mol��L��1��ϡ���ᡣ��ʵ���ҽ���Ҫ��������220 mL���Իش��������⣺
(1)����ϡ����ʱ��Ӧѡ������Ϊ________mL������ƿ��
(2)����ȡŨ����ʱ��ѡ��������Ͳ�е�________��
A��5 mL B��10 mL
C��25 mL D��50 mL
(3)����ȡŨ������������в�����
�ٵ�ϡ�͵�������¶�������һ�º��ز�����ע��250 mL����ƿ�С�
��������ƿ��С�ļ�����ˮ��Һ��������ƿ�̶���1��2 cmʱ�����ý�ͷ�ιܼ�����ˮ��ʹ��Һ��Һ����ʹ���ƿ���Ŀ̶ȱ������С�
����ʢ������ձ���ע������ˮ�����ò�����������ʹ���Ͼ��ȡ�
��������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ��
���������У���ȷ��˳����(�����)________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ������ȷ����( )
A. ��ԭ�ӵĽṹʾ��ͼ: 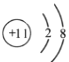
B. �������Ƶĵ���ʽ:![]()
C. ̼�����Ƶĵ��뷽��ʽ:NaHCO3= Na++ H+ + CO32-
D. ������Ϊ12���Ƶĺ��ط���Ϊ: ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CuSO4��Һ�м���H2O2��Һ���ܿ��д��������ݳ���ͬʱ���ȣ�һ��ʱ�����ɫ��Һ��Ϊ��ɫ����(Cu2O)����������H2O2��Һ����ɫ�����ֱ�Ϊ��ɫ��Һ�������Ӧ���Է�����Ρ����й����������̵�˵������ȷ����
A. Cu2+��H2O2�ֽⷴӦ�Ĵ��� B. H2O2ֻ������������
C. H2O2�ĵ���ʽΪ: ![]() D. �����˷�ӦCu2O + H2O2+4H+=2Cu2++3H2O
D. �����˷�ӦCu2O + H2O2+4H+=2Cu2++3H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com