
【题目】下列食品添加剂与类别对应正确的一组是
A.着色剂——胡萝卜素B.调味剂——小苏打
C.防腐剂——山梨酸钾D.营养强化剂——腌制肉类食品中加亚硝酸钠
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值_______(填“增大”、“诚小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是___________。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,该反应使用催化剂的目的是_____________________。已知反应Cu2O+CO![]() 2Cu+CO2若原反应体系中含少量CO2________(填“有利于”“不利于”)维持催化剂Cu2O的量不变。请标出反应Cu2O+CO
2Cu+CO2若原反应体系中含少量CO2________(填“有利于”“不利于”)维持催化剂Cu2O的量不变。请标出反应Cu2O+CO![]() 2Cu+CO2电子转移的方向和数目:___________________________,标准状况下2.24LCO2参与反应,电子转移数为___________个。
2Cu+CO2电子转移的方向和数目:___________________________,标准状况下2.24LCO2参与反应,电子转移数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物在生产与生活中有重要的意义。工业上制备无水FeCl3的一种工艺如下:

(1)吸收塔中吸收剂X是 ____________________。
(2)温度超过673 K,捕集器中的物质相对分子质量为325,该物质的化学式为______是__________________ (填’“离子化合物”或“共价化合物”)
(3)从FeCl3溶液中获得FeCl3·6H2O的方法是__________________________。
(4)向饱和氯化铁溶液中加入足量的氢氧化钠溶液后再加入次氯酸钠可制备高铁酸钠Na2FeO4溶液。写出制备高铁酸钠的离子方程式:________________________
(5)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是______________________。
(6)高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。则高铁放电时,____(填“正”或“负”)极附近溶液的碱性增强。电池正极反应为_________________
3Zn(OH)2+2Fe(OH)3+4KOH。则高铁放电时,____(填“正”或“负”)极附近溶液的碱性增强。电池正极反应为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为25.6%,则氧的质量分数为
A. 36.8%B. 37.6%C. 51.2%D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识解答问题:
![]() 在高温下CuO能分解生成
在高温下CuO能分解生成![]() ,试从原子结构角度解释其原因: ______
,试从原子结构角度解释其原因: ______ ![]() 根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 ______ 区
根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 ______ 区![]()
![]() 氰酸
氰酸![]() 是一种链状分子,它与异氰酸
是一种链状分子,它与异氰酸![]() 互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ______
互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ______ ![]() 其中的C的杂化类型为 ______ .
其中的C的杂化类型为 ______ .
![]() 原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物
原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物![]() 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ______ .
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ______ .
![]() 立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 ______ 个氮原子, ______ 个硼原子,设氮原子半径为apm,硼的原子半径bpm,求该晶胞的空间利用率 ______
立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 ______ 个氮原子, ______ 个硼原子,设氮原子半径为apm,硼的原子半径bpm,求该晶胞的空间利用率 ______ ![]() 用含a、b的代数式表示
用含a、b的代数式表示![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c( )
)
A. a、b、c均能与溴水发生加成反应
B. a、b、c的分子式均为C8H8
C. a的所有原子一定处于同一一平面
D. b的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据信息填空:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3 +Cu ===2FeCl2 +CuCl2,若将此反应设计成原电池,则负极所用的电极材料为____;当线路中转移0.2mol电子时,则被腐蚀的铜的质量为____。
(2)如图所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,可观察到溶液变浑浊,试回答下列问题:
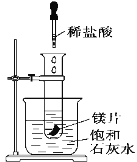
①产生上述现象的原因是___________________________;
②写出有关反应的离子方程式___________________。
③由实验推知,MgCl2和H2的总能量__________(填“大于”、“小于”或“等于”)Mg和HCl的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬合金有重要的用途,从其废料中制取铬的流程如下:
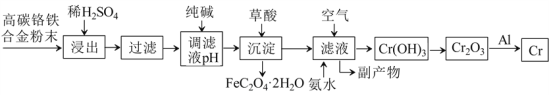
已知: ① Cr+H2SO4=CrSO4+H2↑,
② 流程中铬元素浸出之后至生成Cr(OH)3之间均以自由移动离子状态存在于溶液中。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有:________________________ (写一条即可) 。
(2)用纯碱调节滤液pH,得到某弱碱沉淀,若纯碱过量,则可能导致的后果是_:_____________。
(3)流程中的“副产物”中,可用作可溶性钡盐中毒解毒剂的物质的化学式是___________;可用作化肥的物质的化学式是_____________。
(4)加入草酸实现沉淀转化反应化学方程式为:_______________________________________。
(5)流程中利用铝热反应冶炼铬的化学方程式为:_____________________________________。
(6)流程中由滤液生成Cr(OH)3的化学方程式为:_____________________________________。
(7)除已知反应①之外,整个流程中涉及的主要氧化还原反应有_____个,分解反应有____个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com