
【题目】氨在人类的生产和生活中有着广泛的应用。利用下图装置某化学兴趣小组在实验室制备氨气并进行氨的催化氧化实验。
I制备并收集干燥的氨气
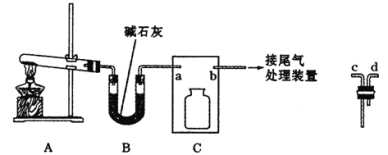
(1)A中反应的化学方程式为________。
(2)B装置的作用为_____,C装置用于收集氨气,则装置中导管的连接顺序为a→__→__→b。
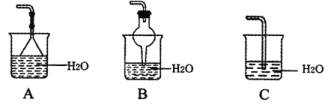
(3)氨气的尾气处理装置不能选用___(填写代号)。
II氨的催化氧化实验
将铂丝烧至红热,放入盛有氨气和空气的锥形瓶中,请回答:

(4)氨的催化氧化反应的化学方程式为_______。
(5)锥形瓶内铂丝始终保持红热状态,说明该反应是___反应(填“吸热”或“放热”)。
(6)锥形瓶内的实验现象为_____。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2 H2O 干燥氨气 d c C 4NH3 + 5O2
CaCl2+2NH3↑+2 H2O 干燥氨气 d c C 4NH3 + 5O2  4NO+6H2O 放热 锥形瓶内产生红棕色气体
4NO+6H2O 放热 锥形瓶内产生红棕色气体
【解析】
实验室常用固体氯化铵和氢氧化钙加热反应制取氨气,再经过干燥,收集氨气时要用向下排空气法收集,氨气极易溶于水,因此再处理尾气时要防倒吸;氨气与氧气在催化剂作用下反应,该反应是放热反应。
⑴A中是固体和固体加热条件下反应,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2 H2O;故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2 H2O;故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2 H2O。
CaCl2+2NH3↑+2 H2O。
⑵B装置盛装碱石灰,其作用为干燥氨气,C装置用于收集氨气,氨气的密度比空气轻,需要短进长出,因此装置中导管的连接顺序为a→d→c→b;故答案为:干燥氨气;d;c。
⑶氨气极易溶于水,要防倒吸,因此氨气的尾气处理装置不能选用C;故答案为:C。
⑷氨的催化氧化生成一氧化氮和水,其反应的化学方程式为4NH3 + 5O2  4NO+6H2O;故答案为:4NH3 + 5O2
4NO+6H2O;故答案为:4NH3 + 5O2  4NO+6H2O。
4NO+6H2O。
⑸锥形瓶内铂丝始终保持红热状态,说明该反应是放热反应;故答案为:放热。
⑹锥形瓶内生成NO,NO和氧气反应生成NO2,因此实验现象为锥形瓶内产生红棕色气体;故答案为:锥形瓶内产生红棕色气体。


科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。图1是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:
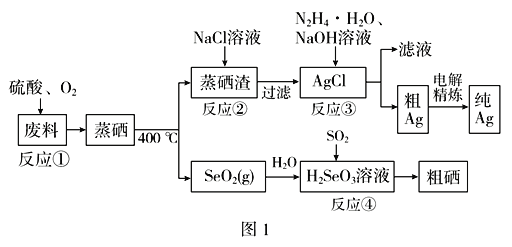
(1)为提高反应①的浸出速率,可采取的措施为______________(答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式__________。
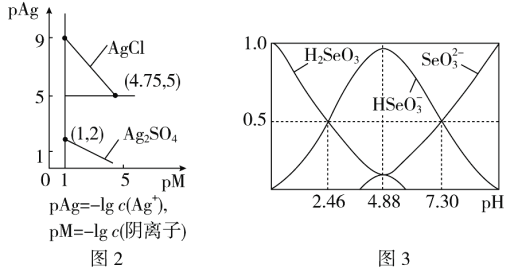
(3)反应②为Ag2SO4(s)+2Cl-(aq)![]() 2AgCl(s)+
2AgCl(s)+![]() (aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq)
(aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+
2AgCl(s)+![]() (aq)的化学平衡常数的数量级为________。
(aq)的化学平衡常数的数量级为________。
(4)写出反应④的化学方程式________________________________________。
(5)室温下,H2SeO3水溶液中H2SeO3、![]() 、
、![]() 的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)是一种新型无机非金属材料,常温下AlN +NaOH+H2O=NaAlO2+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应)。下列说法中正确的是
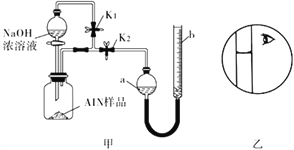
A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”,根据图示回答下列问题:
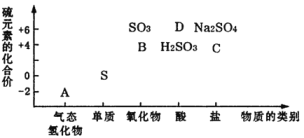
(1)根据“价类二维图”,下列能与B反应的物质有_____,反应中使B表现还原性的物质是__(填序号)。
①NaOH溶液 ②CaCl2溶液 ③酸性KMnO4溶液 ④H2S溶液
(2)C的钠盐放置在空气中极易变质,请设计实验方案证明其已被氧化___。
(3)请写出金属铜与D的浓溶液在一定条件下发生反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③Cl2中35Cl与37Cl两种核素的个数之比与HCl中35Cl与37Cl的个数之比相等
④18 g H2O中含有的中子数为10 NA
⑤离子化合物中一定含有金属元素
⑥只有活泼金属元素与活泼非金属元素之间才能形成离子键
⑦离子化合物中一定含有阴离子和阳离子
⑧通过化学变化可以实现16O与18O间的相互转化
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能通过原电池的形式来实现的是
A.Cu+2Ag+=2Ag+Cu2+B.Cu+2H+=H2↑+Cu2+
C.CaCO3+2HCl=CaCl2+CO2↑十H2OD.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的紫色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)![]() 原子的结构示意图为 _____,YX3的化学式为 _____。
原子的结构示意图为 _____,YX3的化学式为 _____。
(2)![]() 、Q、R原子的半径从大到小的顺序是 ___________。
、Q、R原子的半径从大到小的顺序是 ___________。![]() 用原子符号表示
用原子符号表示![]() 。
。
(3)![]() 分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
(4)能证明R的非金属性比Q强的实验事实是______![]() 填字母序号
填字母序号![]() 。
。
A HR的水溶液酸性比H2Q的水溶液酸性强 B R2与H2化合比Q与H2化合容易。
C R的最高价氧化物的水化物的酸性比Q的强 D HR的稳定性比H2Q强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的密闭容器中,采用不同条件进行反应N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A. v(N2)=0.2mol/(Lmin)B. v(NH3)=0.3mol/(Lmin)
C. v(H2)=0.1mol/(Lmin)D. v(H2)=0.3mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com