
【题目】下列反应能通过原电池的形式来实现的是
A.Cu+2Ag+=2Ag+Cu2+B.Cu+2H+=H2↑+Cu2+
C.CaCO3+2HCl=CaCl2+CO2↑十H2OD.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【答案】A
【解析】
根据原电池的形成条件中“能自发的发生氧化还原反应”判断。
A.Cu+2Ag+=2Ag+Cu2+,反应前后有元素化合价的变化,且该反应是自发进行的氧化还原反应,故A能设计成原电池的形式来实现;
B.Cu+2H+=H2↑+Cu2+,是非自发的氧化还原反应,不能通过原电池反应来实现,只能通过电解来实现,故B不能设计成原电池的形式来实现;
C.CaCO3+2HCl=CaCl2+CO2↑十H2O ,反应前后各元素的化合价不变,所以不是发生氧化还原反应,故C不能设计成原电池的形式来实现;
D.2H2O![]() 2H2↑+O2↑,反应前后有元素化合价的变化,但该反应不是自发的进行的氧化还原反应,只能通过电解来实现,故D不能设计成原电池的形式来实现;
2H2↑+O2↑,反应前后有元素化合价的变化,但该反应不是自发的进行的氧化还原反应,只能通过电解来实现,故D不能设计成原电池的形式来实现;
答案选A。


科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有 100 mL 2 mol·L-1 的盐酸和氢氧化钠溶液,向两烧杯中分别加入一定量的铝粉,反应结束后生成的气体的体积比为 2:3 时,加入铝粉的质量
A.2.7 克B.1.8 克C.4.5 克D.5.4 克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(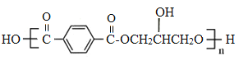 )是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下:
)是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下:

回答下列问题:
(1)D的名称是________B分子中含有的官能团的名称是___________________________。
(2)A→B、B→C的反应类型分别为_____________________、_________________________。
(3)下列说法正确的是_____________________(填字母编号)。
a.A分子存在顺反异构
b.可以用NaHCO3鉴别D和F
c.E分子中最多有14个原子位于同一平面上
(4)写出D+F→G的化学方程式________________________。
(5)H是F的同系物,其相对分子质量比F多28,H的核磁共振氢谱有三组峰,峰面积比为3︰1︰1,则符合该条件的H的同分异构体共有______种,写出其中H的一种结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用。利用下图装置某化学兴趣小组在实验室制备氨气并进行氨的催化氧化实验。
I制备并收集干燥的氨气
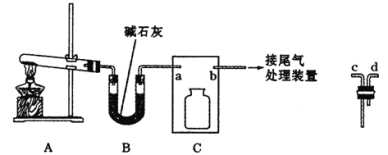
(1)A中反应的化学方程式为________。
(2)B装置的作用为_____,C装置用于收集氨气,则装置中导管的连接顺序为a→__→__→b。
(3)氨气的尾气处理装置不能选用___(填写代号)。
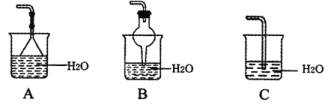
II氨的催化氧化实验
将铂丝烧至红热,放入盛有氨气和空气的锥形瓶中,请回答:

(4)氨的催化氧化反应的化学方程式为_______。
(5)锥形瓶内铂丝始终保持红热状态,说明该反应是___反应(填“吸热”或“放热”)。
(6)锥形瓶内的实验现象为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是![]()
![]()
A.CCl4的电子式:![]()
B.用电子式表示硫化钠的形成过程:![]()
C.14C的原子结构示意图:![]()
D.碳酸氢钙与少量氢氧化钠溶液反应:Ca2+ + 2HCO3- + 2OH- = CaCO3↓+ CO32- + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+H-OH![]() CH3-CH2OH
CH3-CH2OH
C.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D.HCl+AgNO3=AgCl![]() +HNO3
+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
Ⅰ C10H18(l)==C10H12(l)+3H2(g) ΔH1 Ⅱ C10H12(l)==C10H8(l)+2H2(g) ΔH2
假设某温度下, ΔH1>ΔH2>0。在下图中绘制下列“C10H18→C10H12→C10H8”的“能量~反应过程” 示意图正确的是: ( )
A. 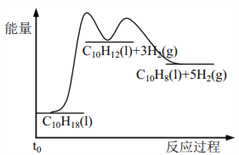 B.
B. 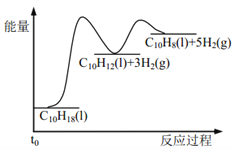
C. 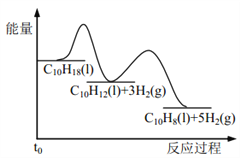 D.
D. 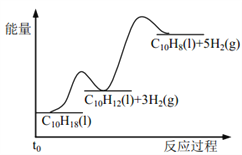
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
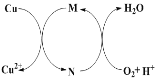
下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com