
【题目】甲、乙两烧杯中各盛有 100 mL 2 mol·L-1 的盐酸和氢氧化钠溶液,向两烧杯中分别加入一定量的铝粉,反应结束后生成的气体的体积比为 2:3 时,加入铝粉的质量
A.2.7 克B.1.8 克C.4.5 克D.5.4 克
【答案】A
【解析】
由2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸碱足量,Al不足,生成气体相同;金属足量,酸碱不足,生成气体为1:3,由铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,反应结束后测得生成的气体体积比为甲:乙=2:3,由化学反应方程式可知,酸与金属反应时酸不过量,Al过量,碱与金属反应时碱过量,Al不足,来计算解答。
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×2mol/L=0.2mol,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则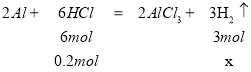 ,解得x=0.1mol,一定条件下,气体的物质的量之比等于体积之比,根据气体体积比为甲:乙=2:3,则碱与金属铝反应生成的氢气的物质的量为0.1mol×
,解得x=0.1mol,一定条件下,气体的物质的量之比等于体积之比,根据气体体积比为甲:乙=2:3,则碱与金属铝反应生成的氢气的物质的量为0.1mol×![]() =0.15mol,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则
=0.15mol,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则 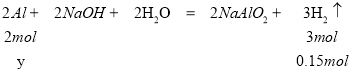 ,解得y=0.1mol,则Al的质量为m(Al)=0.1mol×27g/mol=2.7g;答案为A。
,解得y=0.1mol,则Al的质量为m(Al)=0.1mol×27g/mol=2.7g;答案为A。


科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定碳酸氢钠中杂质氯元素(离子状态)的含量,先称取ag试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用cmol·L-1AgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色。
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):___;
(2)当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5mol·L-1,则此时溶液中的c(CrO![]() )为___mol·L-1。
)为___mol·L-1。
(3)滴定过程中,使用棕色滴定管的原因是___;
(4)当最后一滴AgNO3滴入,___停止滴定。
(5)若此时消耗了AgNO3标准溶液VmL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为___。
(6)下列情况会造成实验测定结果偏低的是___。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代有火烧孔雀石炼铜(加入炭)和湿法炼铜(在溶液中加铁),下列有关说法不正确的是( )
A. 火烧孔雀石炼铜发生的反应有Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
B. 火烧孔雀石炼铜发生的反应有2CuO+C![]() CO2↑+2Cu
CO2↑+2Cu
C. 湿法炼铜发生的主要反应为Fe+Cu2+===Cu+Fe2+
D. 两种炼铜的方法涉及的主要反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
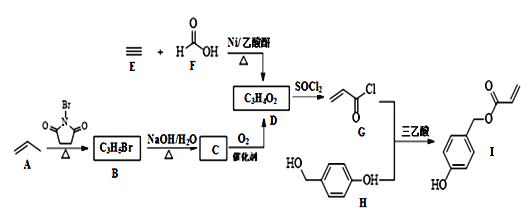
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取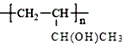 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
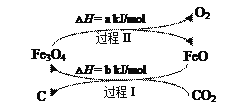
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①己知该反应可以自发进行,则△
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
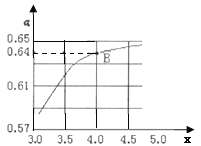
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。图1是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:
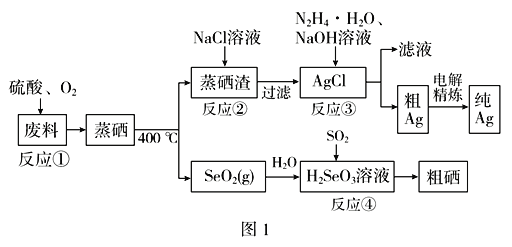
(1)为提高反应①的浸出速率,可采取的措施为______________(答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式__________。
(3)反应②为Ag2SO4(s)+2Cl-(aq)![]() 2AgCl(s)+
2AgCl(s)+![]() (aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq)
(aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+
2AgCl(s)+![]() (aq)的化学平衡常数的数量级为________。
(aq)的化学平衡常数的数量级为________。
(4)写出反应④的化学方程式________________________________________。
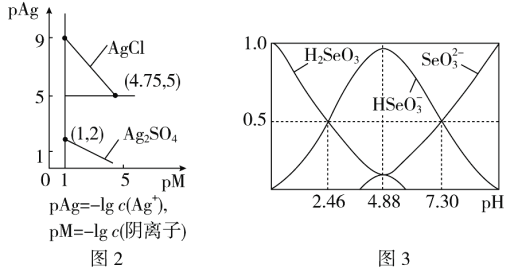
(5)室温下,H2SeO3水溶液中H2SeO3、![]() 、
、![]() 的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能通过原电池的形式来实现的是
A.Cu+2Ag+=2Ag+Cu2+B.Cu+2H+=H2↑+Cu2+
C.CaCO3+2HCl=CaCl2+CO2↑十H2OD.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com