
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
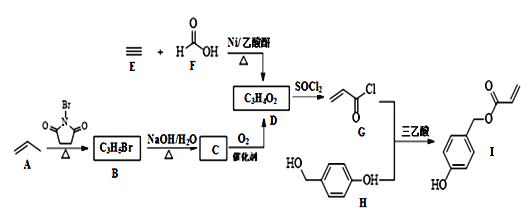
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
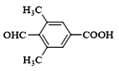
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取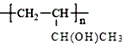 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
【答案】(酚)羟基、酯基 ![]() +NaOH
+NaOH![]() +NaBr 加成反应 取代反应 n
+NaBr 加成反应 取代反应 n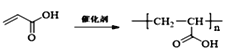
 、
、 CH2=CHCH2CH3
CH2=CHCH2CH3![]() CH2=CHCHBrCH3
CH2=CHCHBrCH3![]() CH2=CHCH(OH)CH3
CH2=CHCH(OH)CH3![]()
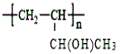
【解析】
由G结构简式、D分子式知,D发生取代反应生成G(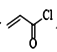 ),D为
),D为![]() ,E和F发生加成反应生成D;由D结构简式知C为
,E和F发生加成反应生成D;由D结构简式知C为![]() ,B发生水解反应生成C,则B为
,B发生水解反应生成C,则B为![]() ,生成B的反应为取代反应,H、G发生取代反应生成I。
,生成B的反应为取代反应,H、G发生取代反应生成I。
(1)I中含氧官能团的名称为羟基、酯基,故答案为:羟基、酯基;
(2)C为![]() 、B为
、B为![]() ,B发生水解反应得到C,由B生成C的化学方程式为
,B发生水解反应得到C,由B生成C的化学方程式为![]() ,
,
故答案为:![]() ;
;
(3)由E和F反应生成D的反应类型为加成反应,由G和H反应生成I的反应类型为取代反应,故答案为:加成反应;取代反应;
(4)D为![]() ,D发生加聚反应可得到高分子化合物,则仅以D为单体合成高分子化合物的化学方程式为
,D发生加聚反应可得到高分子化合物,则仅以D为单体合成高分子化合物的化学方程式为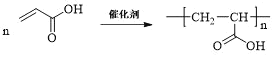 ,
,
故答案为: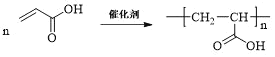 ;
;
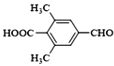
(5)I是对羟基丙烯酸苯甲酯,X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,说明含有醛基、羧基,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。两种符合要求的X的结构简式为 ,
,
故答案为: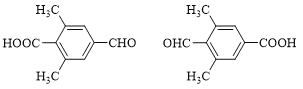 ;
;
(6)1丁烯为原料制取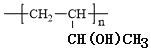 ,
,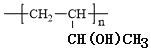 可由CH2=CHCH(OH)CH3发生加聚反应得到,CH2=CHCH(OH)CH3可由CH2=CHCHBrCH3发生取代反应得到,CH2=CHCHBrCH3可由CH2=CHCH2CH3发生取代反应得到,合成路线为CH2=CHCH2CH3
可由CH2=CHCH(OH)CH3发生加聚反应得到,CH2=CHCH(OH)CH3可由CH2=CHCHBrCH3发生取代反应得到,CH2=CHCHBrCH3可由CH2=CHCH2CH3发生取代反应得到,合成路线为CH2=CHCH2CH3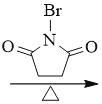 CH2=CHCHBrCH3
CH2=CHCHBrCH3![]() CH2=CHCH(OH)CH3
CH2=CHCH(OH)CH3![]()
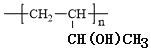 ,
,
故答案为:CH2=CHCH2CH3 CH2=CHCHBrCH3
CH2=CHCHBrCH3![]() CH2=CHCH(OH)CH3
CH2=CHCH(OH)CH3![]()
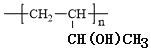 。
。


科目:高中化学 来源: 题型:
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。

(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
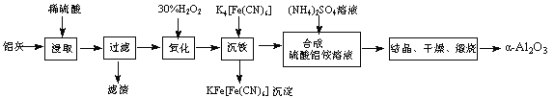
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
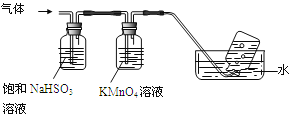
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年我国科研人员研制出一种室温“可呼吸”NaCO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:

A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e—= 2Na2CO3 + C
D.标准状况下,每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如下图所示。
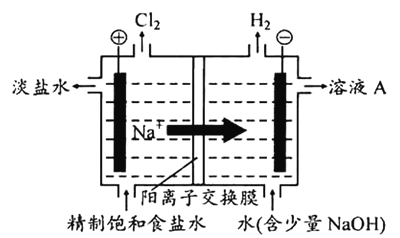
(1)溶液A的溶质是_______。
(2)电解饱和食盐水的离子方程式是_______。
(3)电解时用盐酸控制阳极区溶液的pH在2~3。用化学平衡移动原理解释盐酸的作用:_______。
(4)电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
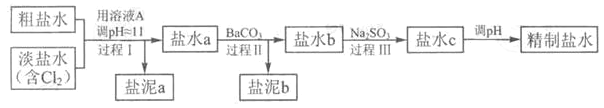
①盐泥a除泥沙外,还含有的物质是________。
②过程I中将NH4+转化为N2的离子方程式是________。
③BaSO4的溶解度比BaCO3的小。过程II中除去的离子有________。
④过程III中Na2SO3的作用是除去盐水b中的NaClO,参加反应的Na2SO3与NaClO的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)![]() 2C(g) ΔH1<0;
2C(g) ΔH1<0;
X(g)+3Y(g)![]() 2Z(g) ΔH2>0。
2Z(g) ΔH2>0。
进行相关操作且达到化学平衡后(忽略体积改变所做的功),下列叙述错误的是
A. 等压时,通入惰性气体,C的物质的量不变
B. 等压时,通入Z气体,反应器中温度升高
C. 等容时,通入惰性气体,各反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家![]() 通过电解氟氢化钾
通过电解氟氢化钾![]() 的氟化氢无水溶液第一次制得氟气。已知:
的氟化氢无水溶液第一次制得氟气。已知:![]() ,制备氟气的电解装置如下图所示。下列说法错误的是( )
,制备氟气的电解装置如下图所示。下列说法错误的是( )

A. 钢电极与电源的负极相连
B. 氟氢化钾在氟化氢中可以电离
C. 阴极室与阳极室必须隔开
D. 电解过程需不断补充的X是KF。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com