
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
【答案】FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl Fe2O3+6H+=3H2O+2Fe3+ 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+ BaSO4↓
Fe(OH)3(胶体)+3HCl Fe2O3+6H+=3H2O+2Fe3+ 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+ BaSO4↓
【解析】
(1)向一定体积的沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸待溶液呈红褐色后,停止加热,反应的离子方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(2)盐酸除铁锈(主要成分Fe2O3)的离子方程式为:Fe2O3+6H+=3H2O+2Fe3+;
(3)NaHSO4溶液与Ba(OH)2溶液混合呈中性生成硫酸钠、硫酸钡和水,反应的离子方程式为:2H++ SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(4)NaHCO3溶液与少量澄清石灰水反应生成碳酸钙、碳酸钠和水,反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;
(5)硫酸铜溶液与氢氧化钡溶液反应的离子方程式为Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+ BaSO4↓。


科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
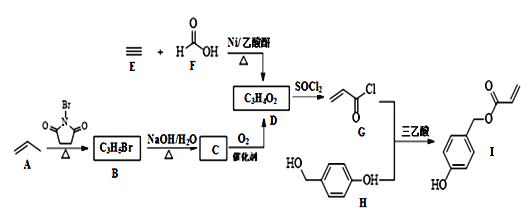
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取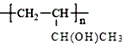 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。
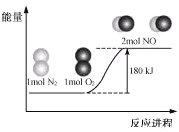
下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是____和______。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为___。(填名称)
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为_________(化学式),写出Cu溶解的离子方程式_______,若要将Cu完全溶解,至少加入H2SO4的物质的量是_________。
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
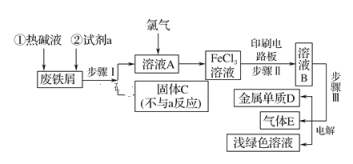
(1)热碱液的作用_____________;
(2)试剂a应选用________(填写名称);
(3)步骤Ⅰ用到的主要玻璃仪器有漏斗、_____(填写仪器名称);
(4)写出步骤Ⅱ中主要反应的化学方程式______;
(5)实验室制取气体E的离子方程式是____,欲对气体E进行干燥和吸收,需选用下列装置中的____(填写序号);
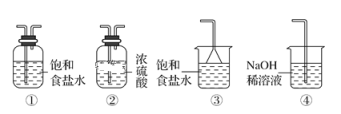
(6)如何用化学方法检验气体E?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤④为过滤,步骤⑤蒸发结晶
D. 步骤③用 CuCO3代替CuO也可调节溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)元素B在元素周期表中的位置是第____周期第_____族,A、B、C三种元素原子半径从大到小的顺序是_________________;
(2)D简单离子的结构示意图为_____________,D、E中金属性较强的元素是________。D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
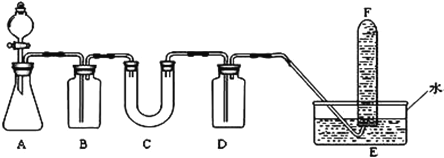
(3)装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________;
(4)装置C中X与CO2反应的化学方程式是_____________________,装置D盛放NaOH溶液的作用是除去____________;
(5)为检验试管F收集的气体,进行____________操作,出现_________现象,即证明X可作供氧剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知D溶液为黄色,E溶液为无色.请回答:
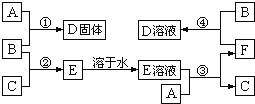
(1)B是_____,F是_____(请填写化学式);
(2)反应③的离子方程式_____;
(3)反应④的离子方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO4 1000 mL,实验室有三种不同浓度的硫酸:
①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com