
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是____和______。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为___。(填名称)
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为_________(化学式),写出Cu溶解的离子方程式_______,若要将Cu完全溶解,至少加入H2SO4的物质的量是_________。
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为__________。
【答案】K2CO3 Ba(OH)2 硫酸铜 Al(NO3)3 3Cu+2NO3—+8H+=3 Cu2++ 2NO↑+4H2O 0.8mol 2FeCl3+2HI=I2+2FeCl2+2HCl
【解析】
(1)因为CO32—只能和五种阳离子中的K+共存,OH-只能和除了K+以外的四个阳离子中的Ba2+共存,故其中必有的两种物质是K2CO3和Ba(OH)2。
(2)C与A的溶液混合时产生蓝色沉淀,则C中含有Cu2+,滴入稀硝酸无气体生成,则A是Ba(OH)2,蓝色沉淀是Cu(OH)2,加入稀硝酸后蓝色沉淀完全溶解,但有白色沉淀剩余,因此C中还应该有硫酸根,故C是硫酸铜。
(3)红棕色气体是NO2,说明D中有硝酸根离子,加入稀硫酸后形成稀硝酸,将铜氧化,这一反应的离子方程式为3Cu+2NO3—+8H+= 3Cu2++ 2NO↑+4H2O。但如果D中有铁离子,铁离子会和铜发生反应,因此D是硝酸铝。38.4g铜是0.6mol,若要完全溶解,需要1.6mol H+,即0.8mol硫酸。故答案为:Al(NO3)3 ;3Cu+2NO3—+8H+= Cu2++ 2NO+4H2O;0.8mol。
(4)根据上述分析可知,E是氯化铁,与氢碘酸反应生成能使淀粉变蓝的物质,该物质是碘,氯化铁充当氧化剂,氢碘酸是还原剂,这一反应的化学方程式为2FeCl3+2HI=I2+2FeCl2+2HCl。


科目:高中化学 来源: 题型:
【题目】2016年我国科研人员研制出一种室温“可呼吸”NaCO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:

A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e—= 2Na2CO3 + C
D.标准状况下,每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家![]() 通过电解氟氢化钾
通过电解氟氢化钾![]() 的氟化氢无水溶液第一次制得氟气。已知:
的氟化氢无水溶液第一次制得氟气。已知:![]() ,制备氟气的电解装置如下图所示。下列说法错误的是( )
,制备氟气的电解装置如下图所示。下列说法错误的是( )

A. 钢电极与电源的负极相连
B. 氟氢化钾在氟化氢中可以电离
C. 阴极室与阳极室必须隔开
D. 电解过程需不断补充的X是KF。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与硫酸的反应: OH+H+=H2O
B.铜片插入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.碳酸钙溶于稀盐酸中: CaCO3+2H+=Ca2++H2O+CO2
D.铁与稀硫酸反应:2Fe +6H+ = 2Fe2+ + 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个N2,含分子数最多的是______(填序号,下同),含电子数最多的是________,质量最大的是______,体积最小的是______;密度由小到大的顺序为________________。
(2)0.5mol某固体A的质量是40g,A的摩尔质量为_________。
(3)质量之比为8∶7的两种气体O2、CO,其分子数之比为_______________;氧原子数之比为____________;相同条件下的体积之比为________。
(4) 4.8g碳在一定量的氧气中燃烧,反应后生成CO和CO2的总质量为12.8g。则在同温同压下,生成的CO和CO2的体积比为__________。
(5)由NaHS,MgSO4,NaHSO3组成的混合物中,硫元素的质量分数为a%,则混合物中氧元素的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
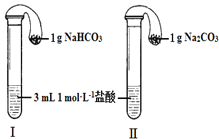
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2![]() 2NO2。其中NO的物质的量[n(NO)]随时间的变化如下表:
2NO2。其中NO的物质的量[n(NO)]随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示达到平衡(假设30 s刚刚达到平衡)时反应速率________,0~10 s与10~20 s的反应速率之比为________。
(2)根据上述数据,能否计算800℃时该反应的平衡常数K________,“能”则计算K,“否”则说明缺少的数据:________。
(3)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(4)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com