
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
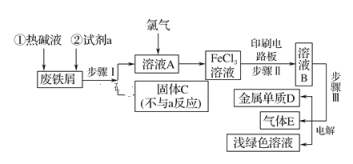
(1)热碱液的作用_____________;
(2)试剂a应选用________(填写名称);
(3)步骤Ⅰ用到的主要玻璃仪器有漏斗、_____(填写仪器名称);
(4)写出步骤Ⅱ中主要反应的化学方程式______;
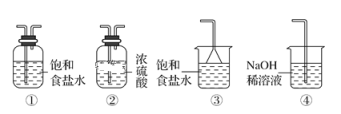
(5)实验室制取气体E的离子方程式是____,欲对气体E进行干燥和吸收,需选用下列装置中的____(填写序号);
(6)如何用化学方法检验气体E?_______。
【答案】除去铁表面的油污 稀盐酸 玻璃棒、烧杯 2FeCl3+Cu=2FeCl2+CuCl2 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O ②④ 淀粉碘化钾试纸用水润湿后粘在玻璃棒一端,靠近装有待测气体的集气瓶,如果黄绿色气体能使试纸变蓝色,证明含有氯气。
MnCl2+Cl2↑+2H2O ②④ 淀粉碘化钾试纸用水润湿后粘在玻璃棒一端,靠近装有待测气体的集气瓶,如果黄绿色气体能使试纸变蓝色,证明含有氯气。
【解析】
(1)废铁屑放置在空气中,表面会附着油污,油污可以在碱性溶液中发生水解,热碱液的作用是除去铁表面的油污。
(2)因为实验目的是以废铁屑为原料制备FeCl3溶液,试剂a的作用是溶解固体,所以应选择稀盐酸,不能选择其他酸的原因是不能引入其他离子。故答案为盐酸。
(3)步骤Ⅰ是过滤,用到的主要的玻璃仪器除了漏斗,还有玻璃棒和烧杯。
(4)步骤Ⅱ的目的是用制备的FeCl3溶液腐蚀印刷电路铜板,这一反应化学方程式为2FeCl3+Cu=2FeCl2+CuCl2。
(5)电解溶液B得到的气体E是氯气,实验室制取氯气用的是浓盐酸和二氧化锰,化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。若对氯气进行干燥,应选用浓硫酸,吸收氯气应选择氢氧化钠溶液,故选②④。
MnCl2+Cl2↑+2H2O。若对氯气进行干燥,应选用浓硫酸,吸收氯气应选择氢氧化钠溶液,故选②④。
(6)检验氯气,可以用淀粉碘化钾试纸,用水润湿后粘在玻璃棒一端,靠近装有待测气体的集气瓶,如果黄绿色气体能使试纸变蓝色,证明含有氯气。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如下图所示。
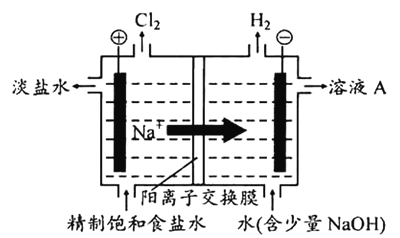
(1)溶液A的溶质是_______。
(2)电解饱和食盐水的离子方程式是_______。
(3)电解时用盐酸控制阳极区溶液的pH在2~3。用化学平衡移动原理解释盐酸的作用:_______。
(4)电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
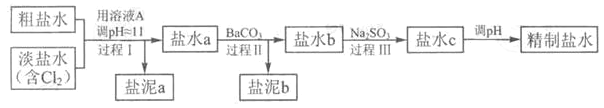
①盐泥a除泥沙外,还含有的物质是________。
②过程I中将NH4+转化为N2的离子方程式是________。
③BaSO4的溶解度比BaCO3的小。过程II中除去的离子有________。
④过程III中Na2SO3的作用是除去盐水b中的NaClO,参加反应的Na2SO3与NaClO的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与硫酸的反应: OH+H+=H2O
B.铜片插入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.碳酸钙溶于稀盐酸中: CaCO3+2H+=Ca2++H2O+CO2
D.铁与稀硫酸反应:2Fe +6H+ = 2Fe2+ + 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A.16g由O2和O3组成的混合气体中的氧原子数为2NA
B.1molN2与足量H2充分反应生成NH3的分子数为2NA
C.1mol Fe溶于过量稀硝酸,转移的电子数为3NA
D.标准状况下,2.24L苯中含有的原子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL 0.2mol/L的NaOH溶液。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_____________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________、____________。
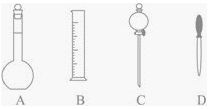
(2)填写下述过程中的空白;
具体步骤如下:
①计算需要称量NaOH固体的质量___________g;
②用托盘天平称量NaOH固体;
③将称好的NaOH固体放入烧杯中,加适量蒸馏水溶解、搅拌,并_________至室温;
④将NaOH溶液沿玻璃棒注入____________中;
⑤用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
⑥将蒸馏水注入容量瓶,液面离刻度线下_______cm时,改用____________滴加蒸馏水至液面于刻度线相切;
⑦盖好瓶塞,反复上下颠倒,摇匀;
(3)经精确测量,最后所得溶液物质的量浓度为0.192mol/L,原因可能是_____________
A.使用滤纸称量NaOH固体;
B.溶解NaOH后的烧杯未经多次洗涤;
C.容量瓶中原来有少量蒸馏水;
D.称量时所用的砝码生锈;
E.未冷却直接转移至容量瓶,立即配好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com