
【题目】为了测定碳酸氢钠中杂质氯元素(离子状态)的含量,先称取ag试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用cmol·L-1AgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色。
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):___;
(2)当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5mol·L-1,则此时溶液中的c(CrO![]() )为___mol·L-1。
)为___mol·L-1。
(3)滴定过程中,使用棕色滴定管的原因是___;
(4)当最后一滴AgNO3滴入,___停止滴定。
(5)若此时消耗了AgNO3标准溶液VmL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为___。
(6)下列情况会造成实验测定结果偏低的是___。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
【答案】酸 Ag++H2O![]() AgOH+H+ 2.8×10-3 防止硝酸银见光分解 出现砖红色沉淀且在半分钟内不再消失时
AgOH+H+ 2.8×10-3 防止硝酸银见光分解 出现砖红色沉淀且在半分钟内不再消失时 ![]() c
c
【解析】
(1)Ag+对应的碱为AgOH,属于弱碱,故Ag+在水中会发生水解:Ag++H2O![]() AgOH+H+,导致溶液呈酸性,故答案为:酸;Ag++H2O
AgOH+H+,导致溶液呈酸性,故答案为:酸;Ag++H2O![]() AgOH+H+;
AgOH+H+;
(2)由氯化银与铬酸银的溶度积可知,氯化银的溶解度小于铬酸银,所以当Cl-恰好沉淀完全时,铬酸银正好开始沉淀,则溶液中银离子浓度为2×10-10mol/L÷1×10-5mol/L=2×10-5mol/L,此时溶液中的c(CrO42-)=(1.12×10-12)÷(2×10-5)2=2.8×10-3mol·L-1,故答案为:2.8×10-3;
(3)由于硝酸银见光分解,使用棕色滴定管的原因是防止硝酸银见光分解,故答案为:防止硝酸银见光分解;
(4)当Cl-恰好沉淀完全时,铬酸银正好开始沉淀,停止滴定,所以当观察到出现砖红色沉淀且在半分钟内不再消失时停止滴定,故答案为:出现砖红色沉淀且在半分钟内不再消失时;
(5)根据题给信息,滴定时发生的反应为Cl-+Ag+=AgCl↓,消耗了AgNO3标准溶液V mL时,n(AgNO3)=cV×10-3mol,则碳酸氢钠样品中杂质氯元素的质量分数表达式为![]() ,故答案为:
,故答案为:![]() ;
;
③a. 盛放AgNO3溶液的滴定管水洗后未用标准液润洗,硝酸银的浓度减小,滴定时所需硝酸银的体积增大,会造成实验测定结果偏高,a错误;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,使读出的硝酸银的体积增大,造成实验测定结果偏高,b错误;
c.滴定前仰视读数,滴定后俯视读数,使读出的硝酸银的体积减小,造成实验测定结果偏低,c正确;
故答案为:c。


科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O64-。试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少______。
(2)滴定操作时,左手控制滴定管,右手_______,眼睛要注视________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由_______色变为_______色。
(4)水中溶解氧的计算式是___(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果____(填“偏高”、“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.1mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1mol·L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
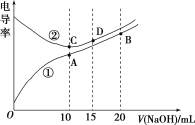
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C.在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度为0.1mol·L-1的5种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl,溶液pH由小到大的顺序为___(填编号)。
(2)MgCl2·6H2O制无水MgCl2要在___气流中加热。
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是___(用离子方程式表示)。
(4)常温下,若1体积的硫酸与2体积pH=11的氢氧化钠溶液混合后的溶液的pH=3(混合后体积变化不计),则二者物质的量浓度之比为___。
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=___mol/L(填精确计算结果的具体数字)。
(6)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是___(填序号)。
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含少量杂质的方法正确的是( )
选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
A | 苯 | 甲苯 | 酸性高锰酸钾溶液和 | 分液 |
B | 苯 | 苯酚 | 浓溴水 | 过滤 |
C | 乙醛 | 乙酸 |
| 分液 |
D | 乙烷 | 乙烯 | 氢气 | 催化剂、加热 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有 100 mL 2 mol·L-1 的盐酸和氢氧化钠溶液,向两烧杯中分别加入一定量的铝粉,反应结束后生成的气体的体积比为 2:3 时,加入铝粉的质量
A.2.7 克B.1.8 克C.4.5 克D.5.4 克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(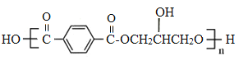 )是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下:
)是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下:

回答下列问题:
(1)D的名称是________B分子中含有的官能团的名称是___________________________。
(2)A→B、B→C的反应类型分别为_____________________、_________________________。
(3)下列说法正确的是_____________________(填字母编号)。
a.A分子存在顺反异构
b.可以用NaHCO3鉴别D和F
c.E分子中最多有14个原子位于同一平面上
(4)写出D+F→G的化学方程式________________________。
(5)H是F的同系物,其相对分子质量比F多28,H的核磁共振氢谱有三组峰,峰面积比为3︰1︰1,则符合该条件的H的同分异构体共有______种,写出其中H的一种结构简式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com