
【题目】(1)25℃时,浓度为0.1mol·L-1的5种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl,溶液pH由小到大的顺序为___(填编号)。
(2)MgCl2·6H2O制无水MgCl2要在___气流中加热。
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是___(用离子方程式表示)。
(4)常温下,若1体积的硫酸与2体积pH=11的氢氧化钠溶液混合后的溶液的pH=3(混合后体积变化不计),则二者物质的量浓度之比为___。
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=___mol/L(填精确计算结果的具体数字)。
(6)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是___(填序号)。
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
【答案】①②⑤④③ HCl Al3++3HCO3-=Al(OH)3↓+3CO2↑ 5:2 9.9×10-7mol/L c
【解析】
(1)HCl和CH3COOH为酸,Ba(OH)2为碱,Na2CO3和KCl为盐,Na2CO3为强碱弱酸盐,其溶液为碱性,KCl为强酸强碱盐,其溶液为中性,CH3COOH为弱酸,部分电离,相同浓度的HCl和CH3COOH,CH3COOH中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则溶液pH由小到大的顺序为①②⑤④③,故答案为:①②⑤④③;
(2)MgCl2·6H2O制无水MgCl2时,由于MgCl2会水解,所以需要在HCl的气流中加热,HCl能够抑制MgCl2的水解,故答案为:HCl;
(3)普通泡沫灭火器的铁筒里装着一只小玻璃筒,玻璃筒内盛装硫酸铝溶液,铁筒里盛装碳酸氢钠饱和溶液。使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡沫,产生此现象是因为Al3+与HCO3-发生双水解反应,反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)H2SO4+2NaOH===Na2SO4+2H2O,设硫酸的物质的量浓度为c,体积为V,氢氧化钠溶液浓度为10-3mol/L,体积为2V,混合后pH=3,即c(H+)=![]() =10-3mol/L,解得c=
=10-3mol/L,解得c=![]() ×10-3mol/L,则二者物质的量浓度之比应为
×10-3mol/L,则二者物质的量浓度之比应为![]() ×10-3mol/L:10-3mol/L=5:2,故答案为:5:2;
×10-3mol/L:10-3mol/L=5:2,故答案为:5:2;
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(H+)=10-8mol/L,c(OH-)=Kw/c(H+)=10-6mol/L,混合后的溶液中存在电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol/L,故答案为:9.9×10-7mol/L;
(6)a.硝酸铵溶于水溶液温度降低是溶解过程是吸热,并没有发生水解反应,a错误;
b.在氨水中加入氯化铵固体,溶液的pH变小,只能说明水解后溶液显酸性,b错误;
c.因碳酸钠溶液显碱性的原因是CO32-+H2O![]() HCO3-+OH-;加热,平衡正向进行,碱性增强,滴有酚酞的溶液颜色加深,则盐类水解是吸热反应,c正确;
HCO3-+OH-;加热,平衡正向进行,碱性增强,滴有酚酞的溶液颜色加深,则盐类水解是吸热反应,c正确;
故答案为:c。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用如图所示装置探究二氧化硫的性质。已知该实验过程可产生足量的二氧化硫。(装置中固定仪器未画出)
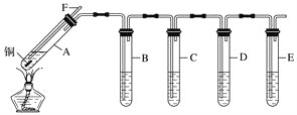
(1)A中所装试剂为铜片和__(填试剂名称),导管F的作用是__。
(2)D中的试剂为0.5mol·L-1BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为__,证明SO2具有__性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液为__(填字母)。
A.酸性高锰酸钾溶液 B.品红溶液
C.石蕊溶液 D.蓝色的碘-淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能的原因,并设计实验验证。
可能原因:__。
实验验证:__。
(5)E中Na2S溶液用于验证SO2的氧化性,可观察到的现象为__。
(6)指出上述装置中的不足之处:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.已知2C(s)+O2(g)=2CO(g);ΔH=-221.0kJ/mol。则C(碳)的燃烧热为110.5kJ/mol
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定碳酸氢钠中杂质氯元素(离子状态)的含量,先称取ag试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用cmol·L-1AgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色。
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):___;
(2)当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5mol·L-1,则此时溶液中的c(CrO![]() )为___mol·L-1。
)为___mol·L-1。
(3)滴定过程中,使用棕色滴定管的原因是___;
(4)当最后一滴AgNO3滴入,___停止滴定。
(5)若此时消耗了AgNO3标准溶液VmL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为___。
(6)下列情况会造成实验测定结果偏低的是___。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
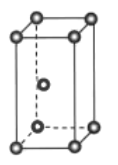
【题目】钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
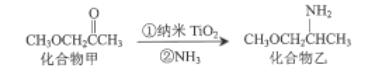
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl36H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______gcm-3.(列出计算式即可)
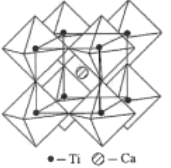
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代有火烧孔雀石炼铜(加入炭)和湿法炼铜(在溶液中加铁),下列有关说法不正确的是( )
A. 火烧孔雀石炼铜发生的反应有Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
B. 火烧孔雀石炼铜发生的反应有2CuO+C![]() CO2↑+2Cu
CO2↑+2Cu
C. 湿法炼铜发生的主要反应为Fe+Cu2+===Cu+Fe2+
D. 两种炼铜的方法涉及的主要反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
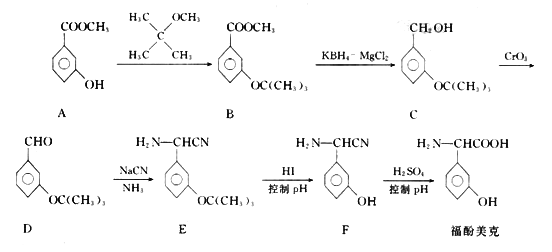
回答下列问题:
(1)物质A的含氧官能团的名称为___________;B→C的转化属于___________反应(填反应类型)
(2)上述流程中设计A→B步骤的目的是________;F分子中共平面的原子最多有________个。
(3)D与银氨溶液发生反应的化学方程式为___________。
(4)福酚美克具有多种同分异构体.写出其中符合下列条件的有机物结构简式:___________和___________。
①含有-CONH2;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱的吸收峰数目有4个。
(5)参照上述合成路线和信息,以乙醇为原料(无机试剂任选),设计制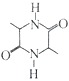 的合成路线:___________。
的合成路线:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com