
【题目】钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
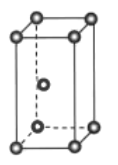
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
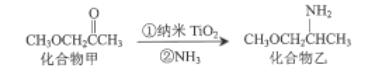
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl36H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
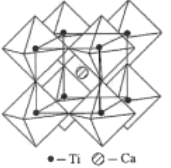
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______gcm-3.(列出计算式即可)
【答案】3d24s2 六方最密堆积 正四面体 TiOSO4+2H2O=H2TiO3↓+H2SO4 N>O>C 化合物乙分子间存在氢键 分子 [TiCl(H2O)5]2+ 12 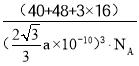 g/cm3或
g/cm3或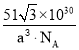 g/cm3
g/cm3
【解析】
(1)钛元素属于过渡元素,价层电子包括最外层电子数和次外层d能级上;根据金属晶体堆积模型进行分析判断;
(2)VSEPR模型的判断是σ键与孤电子对数的和,根据信息完成即可;
(3)同周期从左向右第一电离能逐渐增大,且IIA>IIIA、VA>VIA,据此分析;都属于分子晶体,先看有没有氢键,若没有氢键,从相对分子质量的角度进行分析;
(4)从晶体类型的物理性质上分析TiCl4属于哪种晶体;根据配合物的结构进行分析;
(5)根据晶胞的结构和均摊法进行分析;
(1)钛元素位于第四周期IVB族,价层电子包括次外层d能级和最外层电子数,即Ti的价层电子排布式3d24s2;根据晶胞结构,钛的堆积方式为六方最密堆积;
(2)硫酸氧钛的阴离子为SO42-,价层电子对数=4+![]() =0,VSEPR模型为正四面体;钛酸的化学式为H2TiO3,因此反应方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;
=0,VSEPR模型为正四面体;钛酸的化学式为H2TiO3,因此反应方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;
(3) 同周期从左向右第一电离能逐渐增大,且IIA>IIIA、VA>VIA,三种元素的第一电离能由大到小顺序是N>O>C;化合物乙中-NH2能形成分子间氢键,化合物甲不能形成分子间氢键,因此化合物乙的高于化合物甲的沸点;
(4)TiCl4的熔点为-37℃,沸点为136℃,熔沸点较低,所以TiCl4为分子晶体;1mol该晶体恰好与含2molAgNO3溶液生成白色沉淀,说明1mol该物质中有1molCl与Ti形成配位键,Ti的配位数为6,则该配离子为[TiCl(H2O)5]2+;
(5)根据晶胞结构,每条边长的中点是一个氧原子,共12个氧原子,该晶胞中Ca原子个数是1,Ti原子个数为![]() =1,氧原子的个数为
=1,氧原子的个数为![]() =3,其化学式为CaTiO3,Ca与Ti最近的核间距为apm,则体对角线的距离为2apm,根据勾股定理,晶胞的边长为
=3,其化学式为CaTiO3,Ca与Ti最近的核间距为apm,则体对角线的距离为2apm,根据勾股定理,晶胞的边长为![]() pm,晶胞质量为
pm,晶胞质量为![]() ,根据密度的定义,钙钛矿的密度为
,根据密度的定义,钙钛矿的密度为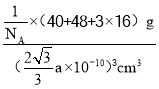 或
或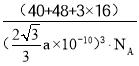 g/cm3或
g/cm3或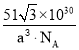 g/cm3。
g/cm3。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是
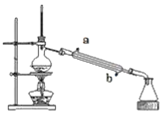
A.蒸馏烧瓶中加入碎瓷片的作用是防止暴沸
B.实验时冷却水应从a进入,从b流出.
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.5 molD.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度为0.1mol·L-1的5种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl,溶液pH由小到大的顺序为___(填编号)。
(2)MgCl2·6H2O制无水MgCl2要在___气流中加热。
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是___(用离子方程式表示)。
(4)常温下,若1体积的硫酸与2体积pH=11的氢氧化钠溶液混合后的溶液的pH=3(混合后体积变化不计),则二者物质的量浓度之比为___。
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=___mol/L(填精确计算结果的具体数字)。
(6)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是___(填序号)。
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol/LBOH溶液滴定20mL 0.1000mol/L一元酸HA溶液,其滴定曲线如右图所示。下列说法正确的是

A. HA的电离平衡常数Ka为1×10-14
B. 滴定时应选择甲基橙作指示剂
C. 当滴入BOH溶液20 mL时,溶液中:c( B+)=c(A-) > c(OH- ) = c(H+)
D. 当滴入BOH溶液10 mL时,溶液中:c(A-)> c(B+)> c(H+)> c( OH- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含少量杂质的方法正确的是( )
选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
A | 苯 | 甲苯 | 酸性高锰酸钾溶液和 | 分液 |
B | 苯 | 苯酚 | 浓溴水 | 过滤 |
C | 乙醛 | 乙酸 |
| 分液 |
D | 乙烷 | 乙烯 | 氢气 | 催化剂、加热 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
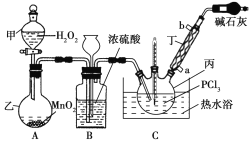
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法正确的是
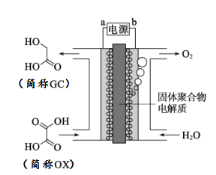
A. 电源的b极为负极
B. 在能量转换过程中,固体电解质中H+由阴极向阳极移动
C. 阴极电极反应式为:OX + 4H+ + 4e﹣═ GC + H2O
D. 为增强阳极电解液导电性,可在水中添加适量NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(A)的结构特殊,根据如下转化判断下列说法正确的是( )
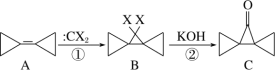
A.反应①、②分别是加成反应和消去反应
B.有机物A 的二氯代物有 4 种(不考虑立体异构)
C.有机物 B 的所有原子都在一个平面内
D.有机物C 的同分异构体中,同时含有苯环和羟基的有 5 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com