
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:[Zn(CN)4]2-+4HCHO+4H2O=Zn2++4HOCH2CN+4OH-
回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
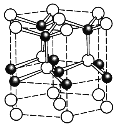
(5)ZnO的一种最稳定的晶体结构如图所示,晶胞中Zn2+的配位数为______。六棱柱底边长为acm,高为bcm,设阿伏加德罗常数的值为NA,则ZnO的密度为_______ g/cm3(列出计算表达式)。
【答案】[Ar]3d10 4 N>O>C 3:1 sp2 HCHO与水分子间存在氢键 配位键 C 4 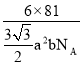
【解析】
(1)基态Zn的电子排布式为[Ar]3d104s2,基态Zn2+的就是[Ar]3d10;C原子核外电子占据4个不同原子轨道,2个s轨道,2个p轨道;
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C ; HOCH2CN分子结构式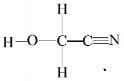 ,单键均为σ键,三键中σ键与π键数目之比为1∶2, 合计σ键6个,π键2个,σ键与π键数目之比为3:1;
,单键均为σ键,三键中σ键与π键数目之比为1∶2, 合计σ键6个,π键2个,σ键与π键数目之比为3:1;
(3)因为它是平面三角形的,或者说从碳原子的键型也可以看出来有两个单键,一个双键, 其中共有3个σ键,所以为sp2杂化;HCHO与水分子间存在氢键,故HCHO极易与水互溶;
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为配位键,提供孤电子对的成键原子是C原子;
(5)晶胞中与Zn2+紧挨着的O原子有4个,Zn2+的配位数为4;
1个晶胞中有Zn2+(白色)3种,顶点12个,面心2个,体心3个,完全属于这个晶胞的Zn2+:12×![]() +2×
+2×![]() +3 =6个,O2-(黑色)在棱上有6个,体心有4个,完全属于这个晶胞的O2-有:6×
+3 =6个,O2-(黑色)在棱上有6个,体心有4个,完全属于这个晶胞的O2-有:6×![]() +4=6个;1个晶胞底面积为
+4=6个;1个晶胞底面积为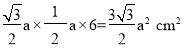 ,体积为
,体积为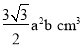 ,1mol ZnO有晶胞
,1mol ZnO有晶胞![]() 个,1mol ZnO体积为
个,1mol ZnO体积为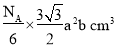 ,1mol ZnO质量是81g,则ZnO的密度为
,1mol ZnO质量是81g,则ZnO的密度为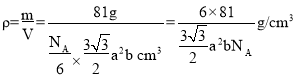 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学宝验室产生的废液必须经处理后才能排放。某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+三种金属阳离子和Cl-种阴离子,实验室设计了下述方案对废液进行处理,以回收金属并测定含量,保护环境。
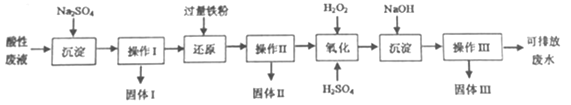
已知实验中处理的酸性废液的体积为IL,用pH计测定出其中H+物质的量浓度为0.10mol·L-1.
请回答下列问题:.
(1)实验中操作I、II、III的方法相同,操作步骤依次为过滤、_________、干燥。
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:_________
(3)检验可排放的废水中不含Fe3+的方法是:_________
(4)实验中称量固体I的质量为4.66g,固体II的质量为15.2g,用足量的稀硝酸溶解固体II后产生了标准状况下的无色气体4.48L,则固体II中金属铜的质量为_________
(5)实验中将固体II进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有_________(填名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物命名正确的是( )
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 3-甲基丁酸
3-甲基丁酸
C.CH3CH(C2H5)CH2CH2CH32-乙基戊烷
D.![]() 2-羟基丁烷
2-羟基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由p(丙烯)制备化合物r(丙烯酸甲酯)的流程如图:
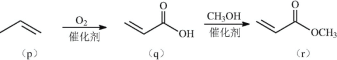
下列说法正确的是( )
A.只有p能发生加聚反应
B.p、q分子中所有原子均可处于同一平面
C.可用![]() 溶液鉴别q和r
溶液鉴别q和r
D.与r含有相同官能团的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuH不稳定,易跟盐酸反应:2CuH+2HCl![]() CuCl2+2H2↑+Cu。下列说法正确的是
CuCl2+2H2↑+Cu。下列说法正确的是
A. CuH中H的化合价为+1 B. CuH在反应中只被还原
C. 在反应中HCl失去电子 D. Cu是反应的还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将18.0 g由Cu、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了5.4 g。另取等质量的合金溶于过量稀HNO3中,生成了8.96 L NO(标准状况下),向反应后的溶液中加入过量的NaOH溶液,则沉淀的质量为
A.22.8 gB.25.4 gC.33.2gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
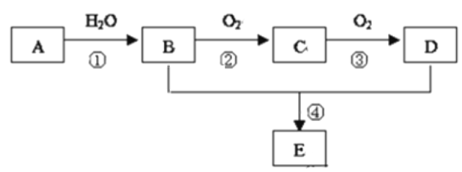
请回答下列问题:
(1)写出A的电子式______________;
(2)D、E分子中官能团的名称是_______、 _________;
(3)写出下列反应的化学方程式:
②_______________________________________,反应类型:____________。
④_______________________________________,反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作正确且能达到预期目的的是
A.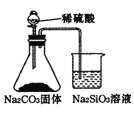 证明碳酸酸性强于硅酸
证明碳酸酸性强于硅酸
B.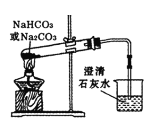 比较NaHCO3和Na2CO3热稳定性
比较NaHCO3和Na2CO3热稳定性
C.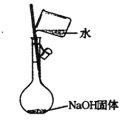 配制0.1mol·L-1NaOH溶液
配制0.1mol·L-1NaOH溶液
D.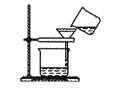 除去粗盐溶液中的泥沙
除去粗盐溶液中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同的锌片和铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生 B. 两烧杯中溶液的H+浓度都减小
C. 产生气泡的速率甲比乙慢 D. 甲中铜片是正极,乙中铜片是负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com