
【题目】实验室制取乙烯并检验乙烯性质的装置如图. 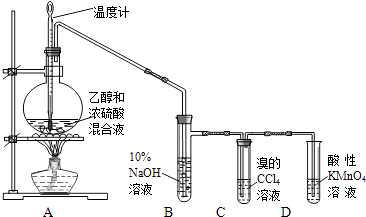
请回答有关问题:
(1)烧瓶中除反应物以外,还应放2﹣3块碎瓷片,目的是 .
(2)烧瓶中产生乙烯的反应方程式为 .
(3)反应开始后,可观察到C和D中共同的现象是;
C中的反应类型为反应、D中的反应类型为反应.
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是;10%的NaOH溶液起的作用是 .
【答案】
(1)防止暴沸
(2)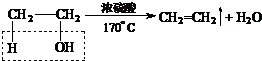
(3)褪色;加成;氧化
(4)浓硫酸将乙醇炭化,浓硫酸被碳还原产生了SO2;吸收挥发出的乙醇、乙酸和其它副产物气体(如乙醚、SO2和CO2等)
【解析】解:(1)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,在圆底烧瓶中放2﹣3块碎瓷片的目的是防止暴沸,所以答案是:防止暴沸;
(2.)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生消去反应,所以实验室制取乙烯的化学方程式为 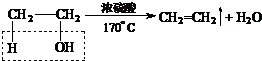 ,
,
所以答案是: 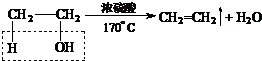 ;
;
(3.)乙烯含有碳碳双键,能和溴发生加成反应Br2+CH2=CH2→BrCH2CH2Br生成1,2﹣二溴乙烷褪色,乙烯被酸性高锰酸钾溶液氧化5CH2=CH2+12KMnO4+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4 , 导致高锰酸钾溶液褪色,所以答案是:褪色;加成;氧化;
(4.)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑是由于乙醇被浓硫酸氧化成碳,CH3CH2OH+4H2SO4(浓) ![]() 4SO2↑+CO2↑+7H2O+C;碳被浓硫酸氧化成二氧化碳,C+2H2SO4(浓)
4SO2↑+CO2↑+7H2O+C;碳被浓硫酸氧化成二氧化碳,C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,且有强烈的刺激性气味气体为二氧化硫,因SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O,所以10%的NaOH溶液起的作用是吸收挥发出的乙醇其它副产物气体(如乙醚、SO2和CO2等)以防干扰检验乙烯性质实验,所以答案是:浓硫酸将乙醇炭化,浓硫酸被碳还原产生了SO2;吸收挥发出的乙醇和其它副产物气体(如乙醚、SO2和CO2等).
CO2↑+2SO2↑+2H2O,且有强烈的刺激性气味气体为二氧化硫,因SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O,所以10%的NaOH溶液起的作用是吸收挥发出的乙醇其它副产物气体(如乙醚、SO2和CO2等)以防干扰检验乙烯性质实验,所以答案是:浓硫酸将乙醇炭化,浓硫酸被碳还原产生了SO2;吸收挥发出的乙醇和其它副产物气体(如乙醚、SO2和CO2等).


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A.用pH试纸测双氧水的pH
B.用酸式滴定管量取20.00 mL酸性KMnO4溶液
C.用托盘天平称取 5.85 g NaCl晶体
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,某种甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100mol·L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是( )

A. 298K时,HCOOH的电离常数Ka=1.0×10-10.25
B. 0.1mol·L-1HCOONa溶液中有c(HCOO-)+c(HCOOH)+c(OH-)<c(H+)+0.1
C. 298K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH-)增大
D. 0.1mol·L-1HCOONa溶液和0.1mol·L-1HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+ O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 |
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。某实验小组以如图所示的装置和试剂,通过反应制备亚硝酸钠 (部分夹持装置略)。
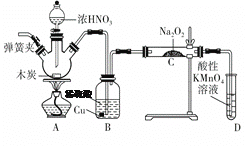
已知:室温下,①2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+。
完成下列填空:
(1)写出A中三种主要玻璃仪器的名称 __________ ,___________,_________。
(2)写出浓硝酸与木炭反应的化学方程式:_______________________。
(3)B中观察到的主要现象是有无色气体产生和______________,D装置的作用是___________________________。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置,则该装置中盛放的药品名称是________。
(5)若NO2可以全部转化成NO,将1.56 g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO45H2O(s)=CuSO4(s)+5H2O(l) ΔH=+Q1kJ·mol-1;室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2kJ,则()
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
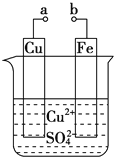
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b用导线连接时,Fe片上发生还原反应,溶液中SO42-向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)== 2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)==CO2(g)+2H2O (l)ΔH=-890.3 kJ·mol-1
C(s)+O2(g)== CO2(g)ΔH=-393.5 kJ·mol-1
根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________。
(2)根据以上反应,则C(s)+2H2(g)== CH4(g)的焓变ΔH=________________。
(3)已知H2O(l)== H2O(g) ΔH=+44.0 kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com