
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。某实验小组以如图所示的装置和试剂,通过反应制备亚硝酸钠 (部分夹持装置略)。
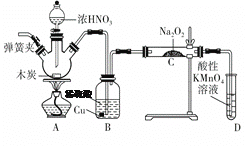
已知:室温下,①2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+。
完成下列填空:
(1)写出A中三种主要玻璃仪器的名称 __________ ,___________,_________。
(2)写出浓硝酸与木炭反应的化学方程式:_______________________。
(3)B中观察到的主要现象是有无色气体产生和______________,D装置的作用是___________________________。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置,则该装置中盛放的药品名称是________。
(5)若NO2可以全部转化成NO,将1.56 g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g。
【答案】 分液漏斗 酒精灯 三颈瓶(或三颈烧瓶,或三口烧瓶) C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 铜片逐渐溶解,溶液变为蓝色 吸收未反应的NO 碱石灰 0.36
CO2↑+4NO2↑+2H2O 铜片逐渐溶解,溶液变为蓝色 吸收未反应的NO 碱石灰 0.36
【解析】(1)根据图中仪器可知,A中三种主要玻璃仪器的名称分液漏斗、酒精灯、三颈瓶(或三颈烧瓶,或三口烧瓶);(2)浓硝酸与木炭反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;(3)三颈瓶中反应生成的二氧化碳和二氧化氮进入装置B,装置B中产生的硝酸与铜反应,故B中观察到的主要现象是有无色气体产生和铜片逐渐溶解,溶液变为蓝色;根据已知,室温下,①2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+,故D装置的作用是吸收未反应的NO,以免污染空气;(4)A装置中产生的NO2和CO2通入到B装置中,由于NO2溶于水生成NO和硝酸,在酸性条件下CO2的溶解度很小,因此从B装置中出来的NO气体中含有CO2以及水蒸气,二者与过氧化钠反应生成碳酸钠、氢氧化钠,因此要排出干扰,需要除去CO2和水蒸气。碱石灰既可以吸收水蒸气,还能吸收CO2,因此该装置中盛放的药品名称是碱石灰;(5)将1.56g过氧化钠是0.02mol,完全转化成为亚硝酸钠,根据①2NO+Na2O2=2NaNO2,生成NaNO2 0.04mol,C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;(3)三颈瓶中反应生成的二氧化碳和二氧化氮进入装置B,装置B中产生的硝酸与铜反应,故B中观察到的主要现象是有无色气体产生和铜片逐渐溶解,溶液变为蓝色;根据已知,室温下,①2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+,故D装置的作用是吸收未反应的NO,以免污染空气;(4)A装置中产生的NO2和CO2通入到B装置中,由于NO2溶于水生成NO和硝酸,在酸性条件下CO2的溶解度很小,因此从B装置中出来的NO气体中含有CO2以及水蒸气,二者与过氧化钠反应生成碳酸钠、氢氧化钠,因此要排出干扰,需要除去CO2和水蒸气。碱石灰既可以吸收水蒸气,还能吸收CO2,因此该装置中盛放的药品名称是碱石灰;(5)将1.56g过氧化钠是0.02mol,完全转化成为亚硝酸钠,根据①2NO+Na2O2=2NaNO2,生成NaNO2 0.04mol,C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O,3NO2+2H2O=2HNO3+NO+H2O,得出关系式1.5C---2NaNO2,可求得碳的物质的量为0.03mol,理论上至少需要木炭0.36g。
CO2↑+4NO2↑+2H2O,3NO2+2H2O=2HNO3+NO+H2O,得出关系式1.5C---2NaNO2,可求得碳的物质的量为0.03mol,理论上至少需要木炭0.36g。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L甲气体和1L乙气体恰好完全反应生成2L丙气体,若丙气体的分子式为XY2,则甲、乙的分子式为:( )
A.X2与Y2B.XY与Y2C.X2与XYD.YX2与Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原氧化铜:CuO + H2 = Cu + H2O,在该反应中,( )
A.CuO做还原剂B.CuO做氧化剂
C.氢元素化合价降低D.铜元素化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
最低价态 | -2 | -4 | -3 | -1 | -3 | -1 |
试回答下列问题
(1) 以上10种元素的原子中,最易失去电子的是__________(填写元素符号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写出2种物质的分子式)_______________,______________
(3) ⑦元素在周期表中位于____________________________.
(4) 第三周期元素R的原子半径为1.02×10-10m,若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式:_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如图. 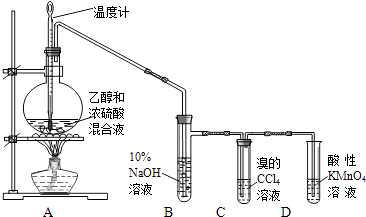
请回答有关问题:
(1)烧瓶中除反应物以外,还应放2﹣3块碎瓷片,目的是 .
(2)烧瓶中产生乙烯的反应方程式为 .
(3)反应开始后,可观察到C和D中共同的现象是;
C中的反应类型为反应、D中的反应类型为反应.
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是;10%的NaOH溶液起的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法中正确的是( )
A.是表示物质多少的单位B.是表示物质数量的单位
C.是以克为单位的质量单位D.是国际单位制中七个基本物理量之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( ) 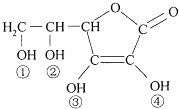
A.维生素C由于含有C═O键而能发生银镜反应
B.维生素C由于含有酯基而难溶于水
C.维生素C的分子式为C6H8O6
D.维生素C的酸性可能是①、②两个羟基引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是____。
(2)放电时,正极发生____(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-====Zn(OH)2,则正极反应为_______________________。
(3)放电时,____(填“正”或“负”)极附近溶液的碱性增强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com