
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
最低价态 | -2 | -4 | -3 | -1 | -3 | -1 |
试回答下列问题
(1) 以上10种元素的原子中,最易失去电子的是__________(填写元素符号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写出2种物质的分子式)_______________,______________
(3) ⑦元素在周期表中位于____________________________.
(4) 第三周期元素R的原子半径为1.02×10-10m,若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式:_________.
【答案】 K PCl3 CCl4 第三周期ⅦA族 ![]()
【解析】主族元素中,元素最高化合价数与其族序数相等,最低化合价数=8-其族序数,同一周期元素中,元素的原子半径随原子序数增大而减小,同一主族中,元素的原子半径随原子序数增大而增大,从表格知,①②⑧最高正价均为+1,为第IA族元素,且都大于⑩的原子半径,则①是Li、②是K、⑧是Na;⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,则⑦是Cl, ⑩是F; ③只有-2价,为VIA族元素,则③是O;④只有+3价,为IIIA族元素,原子半径大于Cl原子半径,则④是Al;⑤有+4、-4价,为IVA族元素,原子半径小于Cl原子半径,则⑤是C;⑥⑨有+5、-3价,为第VA元素,⑥的原子半径大于⑨,则⑥是P, ⑨是N;综合以上分析,①是Li、②是K、③是O、④是Al、⑤是C、⑥是P、⑦是Cl、⑧是Na、⑨是N;
(1) 以上元素中,金属性最强的是K,最易失去电子,因此本题答案为K。
(2) C、P、Cl三种元素中的两种元素形成的化合物有PCl3、CCl4、PCl5,元素化合价的绝对值+其最外层电子数=8,则该原子达到8个电子的稳定结构,所以每个原子都满足最外层为8电子稳定结构的物质为PCl3、CCl4;
(3) Cl元素在周期表中位于第三周期ⅦA族。
(4) R的原子半径为1.02×10-10m,该原子半径在P和Cl之间,故R为S,若物质Na2S3是一种含有非极性共价键的离子化合物,则存在S32-离子,离子中S原子之间形成1对共用电子对且都满足8电子稳定结构,故该化合物的电子式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 非金属氧化物一定为酸性氧化物
B. 分解反应一定有单质生成
C. 向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D. “忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.糖类、油脂、蛋白质都能发生水解反应
B.油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂有油和脂肪之分,都属于酯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 是一种扁桃酸衍生物,下列关于该有机物的说法正确的是
是一种扁桃酸衍生物,下列关于该有机物的说法正确的是
A. 该有机物的分子式为C9H10O3Br
B. 分子中所有的碳原子一定在同一平面内
C. 1mol该有机物最多与2molNaOH反应
D. 该有机物的同分异构体中,属于一元羧酸和酚类化合物且苯环上只有2个取代基的有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。某实验小组以如图所示的装置和试剂,通过反应制备亚硝酸钠 (部分夹持装置略)。
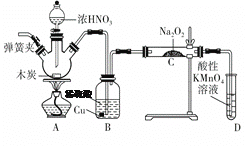
已知:室温下,①2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+。
完成下列填空:
(1)写出A中三种主要玻璃仪器的名称 __________ ,___________,_________。
(2)写出浓硝酸与木炭反应的化学方程式:_______________________。
(3)B中观察到的主要现象是有无色气体产生和______________,D装置的作用是___________________________。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置,则该装置中盛放的药品名称是________。
(5)若NO2可以全部转化成NO,将1.56 g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁和氧化铁的混合物2.72g加入50mL 1.6mol/L的盐酸中,恰好完全反应,滴入KSCN溶液后不显红色,若忽略化学反应中溶液体积的变化,则在所得的溶液中,Fe2+的物质的量浓度为( )
A.0.2mol·L-1 B.0.4mol·L-1 C.0.8mol·L-1 D.1.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素最高价氧化物对应的水化物之间两两皆能反应。请回答下列问题:
(1)B元素的原子结构示意图是______________;D元素在周期表中的位置是第________周期________族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式:_______________________,_______________________________。
(3)写出E2C3分别与盐酸和氢氧化钠溶液反应的离子方程式:_______________________________ ,_________________________________。
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为_____________________________________________________。
(5)A、C、F间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_______________________________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________(填序号)。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
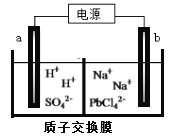
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com