
如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体
反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水橙色褪去
D.含酚酞的NaOH溶液红色变浅

科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是
A、HCl B、Al2(SO4)3 C、Na2CO3 D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
反应CO+H2O(g) CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
A. 将压强减小至原来的一半 B. 将反应温度升高
C. 添加催化剂 D. 增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,下列叙述正确的是
A.2.24 L CO2中含有的原子数为0.3NA
B.0.1 mol F- 中含有的电子数等于0.9NA
C.5.6 g铁粉与氯气反应失去的电子数为0.2NA
D.电解饱和食盐水若产生2 g氢气,则转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.氧化铝既能和盐酸反应又能和氢氧化钠溶液反应均生成盐和水,说明氧化铝是两性氧化物。
B.NaHCO3的热稳定性比Na2CO3强
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+
D.氯气中含有的少量氯化氢可用氢氧化钠溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、同浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗掉的Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸溶液、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s) 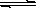 Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
A.溶液中钙离子数目减小 B.溶液中钙离子浓度减少
C.溶液中氢氧根离子浓度增大 D.pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
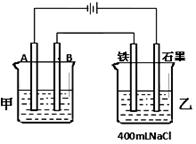
如图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀铜,
则A是 、 (填电极材料和电极名称),电极反应是 ;
B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 水玻璃中通入二氧化碳:Na2SiO3+ CO2 + H2O = H2SiO3 + CO32-+2Na+
B.向氯化亚铁溶液中通入少量氯气:Fe2+ + Cl2 = Fe3+ + 2Cl-
C.硫酸厂的废气SO2用强碱溶液吸收: SO2+ 2OH-== SO42-+ H2O
D.SiO2溶于NaOH溶液:SiO2+2OH- = SiO32-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com