
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
分析 ①饱和碳酸氢钠与氯化氢反应,不与二氧化碳气体反应,则除杂试剂为饱和NaHCO3;
②碳酸钠与二氧化碳反应,碳酸氢钠不反应,可向溶液中通入足量的二氧化碳,将碳酸钠转化成碳酸氢钠;
③铁离子能够与铁粉反应生成亚铁离子,可加入铁粉将铁离子转化成亚铁离子;
④氧化铁不与氢氧化钠溶液反应,而氧化铝具有两性,可用氢氧化钠溶液溶解氢氧化铝;
根据以上分析总结除杂试剂的选用方法.
解答 解:①HCl与饱和碳酸氢钠反应生成二氧化碳,而二氧化碳不与碳酸氢钠反应,则除杂试剂为饱和NaHCO3,发生的反应为:H++HCO3-=H2O+CO2↑;
②NaHCO3溶液中混有Na2CO3,可向溶液中通入足量的二氧化碳,将碳酸钠转化成碳酸氢钠,反应的离子方程式为:CO32-+H2O+CO2=HCO3-;
③FeCl2溶液中混有FeCl3杂质,可加入铁粉将铁离子转化成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
④Fe2O3固体中混有Al2O3杂质,氧化铝具有两性,可用氢氧化钠溶液溶解氢氧化铝,反应的离子方程式为:Al2O3+2OH-=AlO2-+2H2O,
根据以上分析可知,选用除杂试剂时,所选试剂能够将杂质除去,且不能引进新的杂质,
故答案为:
| 物质 | 需加入的除杂试剂(写化学式) | 发生反应的离子方程式 |
| CO2气体中混有HCl | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| FeCl2溶液中混有FeCl3 | 铁粉 | Fe+2Fe3+=3Fe2+; |
| Fe2O3固体中混有Al2O3 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
点评 本题考查了物质的分离与提纯方法、离子方程式书写,题目难度中等,注意掌握常见物质的分离与提纯方法,正确选用除杂试剂为解答关键,注意明确离子方程式的书写原则.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
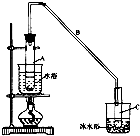 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料. .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑨ | B. | ①②③④ | C. | ②⑥⑨⑩ | D. | ③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com