
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 ①二者反应生成氯化铁;
②次氯酸为弱酸应保留化学式;
③原子个数不守恒;
④二者反应生成氢氧化铝沉淀和氯化铵;
⑤二者反应生成氢氧化钠和氢气;
⑥氢氧化钠过量,反应生成碳酸钠、碳酸钙和水;
⑦二者反应生成硅酸钠和水;
⑧二氧化碳过量反应生成碳酸氢钠.
解答 解:①将氯气通入氯化亚铁溶液中,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故正确;
②氯气跟水反应,离子方程式:Cl2+H2O=H++Cl-+HClO,故错误;
③过氧化钠投入水中,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故错误;
④氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故正确;
⑤钠放入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故正确;
⑥碳酸氢钙溶液中加入足量烧碱溶液,离子方程式:Ca2++2HCO3-+2OH-═CaCO3+2H2O+CO32-,故错误;
⑦二氧化硅与浓的氢氧化钠溶液反应,离子方程式:SiO2+2OH-═SiO32-+H2O,故正确;
⑧漂白液中通入过量CO2,离子方程式:ClO-+H2O+CO2═HClO+HCO3-,故错误;
故选:B.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应应遵循客观事实,遵循原子个数、电荷数守恒规律,注意反应物用量对反应的影响,题目难度中等.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:填空题
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
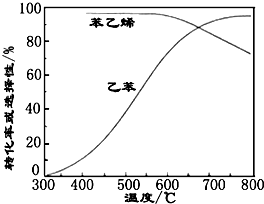
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
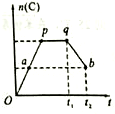 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应过程中的氧化产物均为SO3 | |
| B. | a点时消耗NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I?与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5% | B. | 25% | C. | 17% | D. | 33% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com