
| A、v (A)=0.15 mol?L-1?s-1 |
| B、v (B)=0.3 mol?L-1?s-1 |
| C、v (C)=0.5 mol?L-1?s-1 |
| D、v(D)=0.4 mol?L-1?s-1 |
| v(A) |
| 3 |
| v(B) |
| 3 |
| v(C) |
| 2 |
| v(D) |
| 2 |


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,Zn作负极,发生还原反应 |
| B、放电时,K2FeO4附近溶液pH减小 |
| C、充电时,锌极附近溶液pH减小 |
| D、充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质均只能作还原剂,离子只能作氧化剂 |
| B、活动性强的金属均可从盐溶液中置换出活动性弱的金属 |
| C、碱性氧化物都是金属氧化物 |
| D、合金均比纯金属的熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
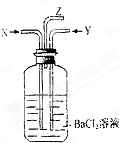 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )| A、洗气瓶中产生的沉淀是BaCO3 |
| B、在Z导管出来的气体中无CO2 |
| C、洗气瓶中产生的沉淀是BaSO3 |
| D、在Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°.下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°.下列有关N(NO2)3的说法正确的是( )| A、分子中N、O原子间形成的共价键是非极性键 |
| B、分子中四个氮原子共平面 |
| C、该物质既有氧化性又有还原性 |
| D、分子中四个氮原子围成一个空间正四面体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com