
����Ŀ������β���к���CO��NO���к����塣
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������

��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���

��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������

��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
���𰸡����� 180 ���� NiO O2+4e��=2O2�� 1.2��10��3 ������ �� CD
��������
��1����ͼ��֪��1molN2��1molO2��ȫ��Ӧ����NOʱ�����յ����������ڷų������������÷�ӦΪ���ȷ�Ӧ��
��2��ԭ��ع���ʱ���������������ƶ������������ƶ��������ӵĶ����ƶ���֪NiO��Ϊԭ��صĸ�����Pt��Ϊԭ��ص�����������������ԭ��Ӧ����������������Ӧ��
��3���������֪����ʵ��Ŀ��֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ʵ��ʱӦע������������ͬ������£������жϱ��������ʵ�Ӱ�죬Ҫ��֤�¶ȶ����ʵ�Ӱ�죬�����ıȱ��������Ӧ��ij�ʼŨ�ȵ�Ҫ��ͬ��ͬ����֤�����ıȱ���������ʵ�Ӱ�죬�¶ȡ���Ӧ��ij�ʼŨ��Ҫ��ͬ��
��4����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��
��1����ͼ��֪��1molN2��1molO2��ȫ��Ӧ����NOʱ����Ӧ�ﻯѧ���ƻ����յ�������Ϊ946kJ +498kJ=1444kJ���������γɻ�ѧ���ų���������Ϊ2��632kJ=1264kJ����Ӧʱ��Ҫ����180kJ���������ʴ�Ϊ�����գ�180��
��2����ԭ����У�NiOΪ�������缫��NOʧ���ӷ���������Ӧ���ɶ����������ʴ�Ϊ��������
�����·�У������ɸ���NiO����������������������Pt�����ʴ�Ϊ��NiO��
��ԭ����У�Pt�缫Ϊ������ O2�������Ϸ�����ԭ��Ӧ����O2-���缫��ӦʽΪO2+4e��=2O2�����ʴ�Ϊ��O2+4e��=2O2����
��3�����ɱ������ݿ�֪��ʵ����¶���ͬ�������ıȱ������ͬ��ʵ��Ŀ������֤�����ıȱ���������ʵ�Ӱ�죬���¶Ⱥͷ�Ӧ��ij�ʼŨ��Ҫ��ͬ��ʵ��I��������ıȱ������ͬ���¶Ȳ�ͬ��ʵ��Ŀ������֤�¶ȶ����ʵ�Ӱ�죬��Ӧ��ij�ʼŨ��Ҫ��ͬ��aӦ��Ϊ1.2��10��3mol/L���ʴ�Ϊ��1.2��10��3��
���ɱ������ݿ�֪��ʵ��I��������ıȱ������ͬ���¶Ȳ�ͬ��ʵ��Ŀ������֤�¶ȶ����ʵ�Ӱ�죬�ʴ�Ϊ����͢�
���������ıȱ������ͬ���¶���ͬ����Ӧ��ij�ʼŨ�ȣ������ıȱ������ƽ���ƶ���Ӱ�죬��������ʴ��ȴﵽ��ѧƽ�⣬��ʵ���ѡ�����ң��ʴ�Ϊ���ң�
��4��A����Ӧ�ھ��������н��У������ڻ�������¶Ȼ�仯�����¶Ȳ��ٱ仯ʱ��˵����Ӧ�Ѵﵽƽ�⣻
B���÷�Ӧ��һ�����������С�ķ�Ӧ���������ڵ�����ѹǿ���ֲ��䣬˵�����淴Ӧ������ȣ���Ӧ�Ѵﵽƽ�⣻
C����Ӧ�Ѵﵽƽ�⣬���淴Ӧ������ȣ�����(NO)= 2����(N2)��2����(NO)=����(N2)˵����Ӧû�дﵽƽ��״̬��
D���������غ㶨�ɿ�֪����Ӧǰ�������������䣬������������䣬�������ڻ�������ܶ�һֱ���ֲ��䣬���������ܶȲ��䲻��˵����Ӧ�Ѵﵽƽ�⣻
����˵����Ӧ�Ѵ�ƽ��״̬��ΪCD���ʴ�Ϊ��CD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ִ���������Һ�����䷢���ʾ��ͼ��ͼװ�ù���ʱ������˵������ȷ���ǣ�������

A. ����ϸ���Ե�����������������
B. ������K+��Y���ƶ�
C. ������Y���ص�������X��
D. Y�������ķ�ӦΪ��2NO3��+10e��+12H+�TN2��+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�ҵ�ϣ���������ұ�����۽�������һ��;��Ҫ��������(����)
A.����ǿ��ԭ�ԣ���Ӧ�зų���������
B.����ʱ�ڿ�������ȼ��
C.�������õ�����
D.��Ӧ�������۵���ߵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ղ������ɫ��Ѫ�졢��֡����ơ���ɫ˳�����е��� �ٽ�������������ȼ�� �ڿ�����FeSO4��Һ�е���NaOH��Һ ��FeCl3��Һ�е���KSCN��Һ ����ˮ����ͭ����ҽ�þƾ���
A. �ڢۢ٢� B. �ۢڢ٢� C. �ۢ٢ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȼҵ�IJ�Ʒ������SC/����������������ͼ��ʾ������˵���������

A. ��NaHSO3��Һ�м�������I2��C(H2SO3)/C(HSO3-)����С
B. �ȼҵ�IJ�Ʒ������������Ư��
C. ����װ���з��������ӷ�ӦΪHSO3-+H+=SO2��+H2O
D. ���������п�ѭ�����õ�������NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п�����Ҫ�ɷ�ΪZnS������������FeS�������ɷ֣�������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ��

(l)��п���չ����в����ij�¯�����ɾ������ᣬ���ڽ�����������������е���Ҫ��ѧ����ʽΪ_______��
(2)����������Fe3+Ũ�Ƚϸߣ����ȼ���SO2��ZnS��Fe3+��ԭΪFe2+������ZnO������Һ��ȣ���Fe2+ת����������( FeOOH)�����γɽ���������Fe2+�������̵��ܻ�ѧ����ʽΪ_____________��
(3)��֪�������������Һ��c(Zn2+)=0.2 mol/L��������Һ��0.4 mol/L��Na2S��Һ�������ϣ���ַ�Ӧ�����Һ��c(Zn2+)=_______��ZnS���ܶȻ�����Ksp=1. 20��10-23��
(4)�������������Һ�����������ڽ��е�����ɵõ���п��ԭ������ͼ��ʾ��

�������ĵ缫��ӦʽΪ___________��
��������(C2H5OC2H5)����ȼ�ϵ��Ϊ��Դ�������ȡ��пʱ���������ڳ���1.3gп������������-����ȼ�ϵ������____g���ѡ�
(5)����ұ�������еı��չ������¿�����Ⱦ�����á���ѹ��������̣��ȿ�ʡ�Ա��չ����ֿɻ��һ�ַǽ������ʡ�����ѹ����������з�������Ҫ��Ӧ�����ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2������ɫ������ˮ������)��һ�ְ�ȫ�ȶ�����Ч�Ͷ�������������ҵ��ͨ�����Ե缫����Ȼ�狀�����ķ����Ʊ�����ԭ����ͼ��ʾ:
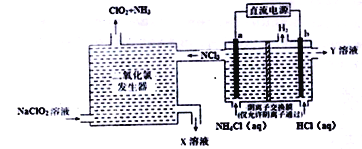
����˵������ȷ����
A. b�缫�ӵ�Դ�ĸ�������b����������Y��Һ��ϡ����
B. �������ȷ��������ų���X��Һ��������ҪΪNaCl��NaOH
C. �������ж������ȷ������в���2.24L(��״��)NH3����b������0.6gH2
D. ����a���ĵ缫��ӦʽΪNH4+-6e-+4OH-+3Cl-=NCl3+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з�һС����,�������ۻ�ʱ,�ò�����ȡ������ˮCuSO4���ۻ�������Ӵ�˲�����ҫ�۵Ļ�,ͬʱ�к�ɫ�������ɡ��ݴ�������˵���в���ȷ����
A. ������Ӧ���û���Ӧ
B. ������Ӧ�Ƿ��ȷ�Ӧ
C. ������Ӧ����ˮCuSO4�����˻�ԭ��
D. ��������ˮ������,�ƿ�����CuSO4��Ӧ������Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��NaClO��Һ�ڼ��������½�CN������������̼������Ӻ�N2���÷�Ӧ���ӷ���ʽ________________________________��
��2��NH3��H2O�ĵ��뷽��ʽΪNH3��H2O![]() NH4����OH�������ж�����ˮ���γɵĺ����ṹ��________��(��ͼ�е���ĸ)
NH4����OH�������ж�����ˮ���γɵĺ����ṹ��________��(��ͼ�е���ĸ)

��3����CoCl2����ˮ��Ӱ�ˮֱ�������ɵ�Co(OH)2�������ܽ���ټӰ�ˮ��ʹ����[Co(NH3)6]2������ʱ����Һ��ͨ��������õ��IJ�������һ������ɿ���CoCl3��5NH3��ʾ��Co����λ����6���ѷ������CoCl3��5NH3����ˮ����������������Һ��������AgCl���������ⶨ��ÿ1molCoCl3��5NH3ֻ����2molAgCl��CoCl3��5NH3��Co���ϼ�Ϊ__________����д����ʾ�������ṹ�Ļ�ѧʽ��______________��
��4��H2O��H2S��H2Se�۷е��ɵ͵��ߵ�˳��_________________��
��5��HF��HCl���ȶ���____���ǿ������������ԭ���ǣ�________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com