
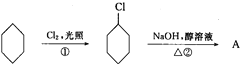
【题目】从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应。试回答:
![]()
![]()
(1)反应①反应类型属于______________。
(2)羟基的电子式______________。
(3)化合物的结构简式:B______________,C______________。
(4)反应④所用试剂和条件是______________。
(5)完成以下步骤方程式(注明反应条件)④______________。
【答案】取代反应 ![]()
![]()
![]() NaOH的醇溶液,加热
NaOH的醇溶液,加热  +2NaOH
+2NaOH![]() 2NaCl+2H2O+
2NaCl+2H2O+![]()
【解析】
![]() 和Cl2在光照条件下发生取代反应生成
和Cl2在光照条件下发生取代反应生成![]() ,
,![]() 在氢氧化钠醇作用下发生消去反应生成A,A为
在氢氧化钠醇作用下发生消去反应生成A,A为![]() ,
,![]() 与氯气发生加成反应生成B,B为
与氯气发生加成反应生成B,B为![]() ,
,![]() 发生消去反应生成
发生消去反应生成![]() ,
,![]() 与溴水发1,4加成生成
与溴水发1,4加成生成![]() ,
,![]() 发生水解生成C,C为
发生水解生成C,C为![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成![]() ,据此解答。
,据此解答。
(1)根据以上分析,反应①为环己烷和氯气在光照条件下发生的取代反应,反应类型属于取代反应,
故答案为:取代反应;
(2)羟基是由一个氧原子和一个氢原子构成的,电子式为![]() ,
,
故答案为:![]() ;
;
(3)根据以上分析,化合物B的结构简式为:![]() ,C的结构简式为:
,C的结构简式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(4)反应④为![]() 发生消去反应生成
发生消去反应生成![]() ,为卤代烃的消去反应,所用试剂和条件是NaOH的醇溶液,加热,
,为卤代烃的消去反应,所用试剂和条件是NaOH的醇溶液,加热,
故答案为:NaOH的醇溶液,加热;
(5)反应④为![]() 发生消去反应生成
发生消去反应生成![]() ,化学方程式为:
,化学方程式为: +2NaOH
+2NaOH![]() 2NaCl+2H2O+
2NaCl+2H2O+![]() ,
,
故答案为: +2NaOH
+2NaOH![]() 2NaCl+2H2O+
2NaCl+2H2O+![]() 。
。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是

A. Z、N两种元素的离子半径相比,前者大
B. X、N两种元素的氢化物的沸点相比,前者较低
C. M比X的原子序数多7
D. Z单质均能溶解于Y的氢氧化物和N的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
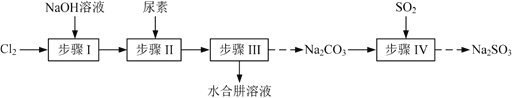
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
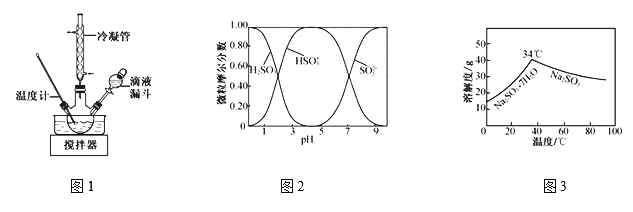
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装(结合图2、图3说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是()
①向溴乙烷中加入硝酸银溶液可检验溴元素
②顺-2-丁烯和反-2-丁烯的加氢产物相同
③苯和溴水混合可制溴苯
④可用银镜反应区分甲酸和乙醛
A.只有①和④B.只有②和③C.只有①和③D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 比较Ksp(BaCO3)<Ksp(BaSO4) | 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa和NaClO溶液的pH |
C | 配制480 mL 0.2 mol·L1 CuSO4溶液 | 将25 g CuSO4·5H2O溶于蒸馏水配成500 mL溶液 |
D | 验证Na2SO3是否变质 | 在Na2SO3溶液中滴入Ba(NO3)2溶液产生白色沉淀,滴入盐酸沉淀不溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和氨水中存在化学平衡和电离平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-。下列有关说法正确的是( )
+OH-。下列有关说法正确的是( )
A. 常温下饱和氨水的pH<7
B. 向氨水中滴加过量硫酸,所有平衡均正向移动,pH增大
C. 电离是吸热过程,升高温度,所有平衡均正向移动
D. 向饱和氨水中加入适量NaOH固体,所有平衡均逆向移动,有NH3放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___________________mol·L-1。
(2)下列微粒:①S ②SO32- ③Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是________(填序号),只能表现出氧化性的是______(填序号)。
(3)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
(4)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(5)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
____Al+____NO3-+____□ ——____AlO2-______N2↑+____H2O,_____________
(6)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com