
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___________________mol·L-1。
(2)下列微粒:①S ②SO32- ③Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是________(填序号),只能表现出氧化性的是______(填序号)。
(3)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
(4)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(5)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
____Al+____NO3-+____□ ——____AlO2-______N2↑+____H2O,_____________
(6)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
【答案】(2b-4a)/V ⑤ ④ 1.5 1:2:2:1 10Al+6NO3-+4 OH- == 10 AlO2-+ 3 N2↑+ 2 H2O I2、KIO3 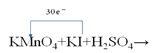
【解析】
(1)Ba2+完全沉淀,消耗a mol H2SO4,Ba2++SO42-=1:1,即有amol的BaCl2,就有2amol Cl-,要使Cl-完全沉淀,需要bmol AgNO3,Ag+:Cl-=1:1,总共有bmol的Cl-,减去BaCl2 中含有的2amol Cl-,就是KCl中含有的Cl-,K+离子和Cl-为1:1的关系,所以K+离子的物质的量浓度为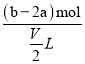 =
=![]() mol/L;
mol/L;
(2)①S的化合价处于中间价态,所以既有氧化性又有还原性;
②SO32-中S的化合价处于中间价态,所以既有氧化性又有还原性;
③Fe2+的化合价处于中间价态,所以既有氧化性又有还原性;
④Al3+的化合价处于最高价态,只有氧化性;
⑤Na的化合价处于最低价态,只有还原性;
⑥HCl中氢元素的化合价处于最高价态,只有氧化性;Cl元素的化合价处于最低价态,只有还原性;所以HCl既有氧化性又有还原性;
⑦Na2O2中Na元素的化合价处于最高价态,只有氧化性;O的化合价处于中间价态,所以既有氧化性又有还原性;
结合以上分析可知,在化学反应中,该物质做还原剂,只能被氧化的是⑤;该物质只做氧化剂,只能表现出氧化性的是④;
(3)利用电子守恒,当1molCr3+被氧化为Cr2O72-(0.5mol)时,所失去的电子数为3mol,这些电子被PbO2得到,而1mol PbO2被还原只得到2mol电子,因此需要PbO2的物质的量为1.5mol;
(4)过氧化氢中氧元素的化合价是-1价,高锰酸钾、氯酸钾中氧元素的化合价均为-2价;过氧化钠中氧元素的化合价为-1价,所以当制得同温、同压下相同体积的氧气时,四个反应中转移的电子数之比为1:2:2:1;
(5)Al→AlO2-中,铝元素化合价升高了3价,2NO3-→N2中,氮元素化合价升高了5价,共变化了10价;根据氧化还原反应中化合价升降总数相等规律可知,Al填系数10,AlO2-填系数10,NO3-填系数6,N2填系数3,最后根据电荷守恒及原子守恒配平其它物质的系数,具体如下:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;
(6)①在氧化还原反应中,元素化合价的变化与发生反应的关系是:“升失氧,降得还,若说剂,正相反”。在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,锰元素化合价由+7价降低为+2价,锰元素被还原,还原产物是MnSO4,KMnO4是氧化剂,I元素的化合价由﹣1价升高为I2中的0价和KIO3中的+5价,KI作还原剂,发生氧化反应,
②该反应方程式中I2和KIO3的计量数分别是是6和3,则12KI~6I2,3KI~3KIO3,反应中碘元素失去的电子总数为[0﹣(﹣1)]×12+[+5﹣(﹣1)]×3=30,在氧化还原反应中,用单线桥表示电子转移的方法是,从还原剂中变化的元素出发指向氧化剂中变化的元素,因此该反应中电子转移的方向和数目可表示为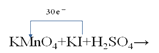 。
。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
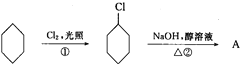
【题目】从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应。试回答:
![]()
![]()
(1)反应①反应类型属于______________。
(2)羟基的电子式______________。
(3)化合物的结构简式:B______________,C______________。
(4)反应④所用试剂和条件是______________。
(5)完成以下步骤方程式(注明反应条件)④______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅的下列叙述中,错误的是 ( )
A.在自然界中,硅既能以游离态形式存在,又能以化合态形式存在
B.单质硅是良好的半导体材料
C.常温下,硅可以与氟气、强碱溶液起反应
D.晶体硅和金刚石具有类似的空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号 | 加入的酸 | 加入酸的浓度/(mol/L) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·eH2O]在一定条件下的转化如下图所示,下列说法不正确的是

A. Q可能为NH3B. a、b、c、d符合关系式:2a+3b=c+2d
C. X可能为NaOHD. 碱式碳酸铝镁医疗上可用做抗酸剂,工业上可用做阻燃剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中![]() 的比值变小,可采取的措施是( )
的比值变小,可采取的措施是( )
①加适量盐酸
②加适量NaOH(s)
③加适量KOH(s)
④加适量KHS(s)
⑤加水
⑥通H2S(g)
⑦加热.
A.②③④ B.①②⑤⑥⑦ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是
A. 苯分子的比例模型:
B. CO2的电子式:![]()
C. Cl-离子的结构示意图:
D. 乙烯的结构式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是 ( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com