
【题目】常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号 | 加入的酸 | 加入酸的浓度/(mol/L) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
【答案】D
【解析】0.10mol/L的HA与0.10molL-1的NaOH溶液等体积混合,恰好完全反应生成NaA,溶液的pH=8.7,显碱性,说明NaA为强碱弱酸盐,即HA为弱酸;0.12mol/L的HB与0.10molL-1的NaOH溶液等体积混合,反应后剩余的酸的浓度为c(HB)=![]() =0.01mol/L,溶液中c(H+)=0.01mol/L,所以HB完全电离,即HB为强酸。A.由分析可知,HA是弱酸,HB是强酸,故A错误;B.NaB强酸强酸碱盐,升高温度,B-、Na+的浓度不变,所以溶液②中c(B-)/c(Na+)不变,故B错误;C.溶液①中,恰好完全反应生成NaA,溶液的pH=8.7,显碱性,c(OH-)>c(H+),水解程度较小,所以c(A-)>c(OH-),则离子浓度的关系:c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;D.溶液②中c(H+)=0.01mol/l,c(B-)=0.12 molL-1×
=0.01mol/L,溶液中c(H+)=0.01mol/L,所以HB完全电离,即HB为强酸。A.由分析可知,HA是弱酸,HB是强酸,故A错误;B.NaB强酸强酸碱盐,升高温度,B-、Na+的浓度不变,所以溶液②中c(B-)/c(Na+)不变,故B错误;C.溶液①中,恰好完全反应生成NaA,溶液的pH=8.7,显碱性,c(OH-)>c(H+),水解程度较小,所以c(A-)>c(OH-),则离子浓度的关系:c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;D.溶液②中c(H+)=0.01mol/l,c(B-)=0.12 molL-1×![]() =0.06mol/L,c(Na+)=0.1mol/L×
=0.06mol/L,c(Na+)=0.1mol/L×![]() =0.05mol/L,所以c(Na+)+c(H+)+c(B-)=0.12 molL-1,故D正确;故选D。
=0.05mol/L,所以c(Na+)+c(H+)+c(B-)=0.12 molL-1,故D正确;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
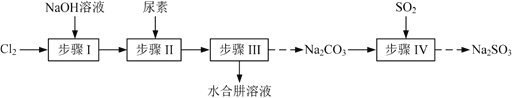
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
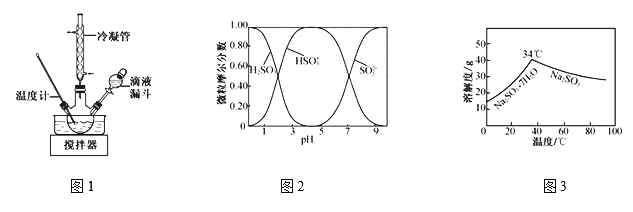
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装(结合图2、图3说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和氨水中存在化学平衡和电离平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-。下列有关说法正确的是( )
+OH-。下列有关说法正确的是( )
A. 常温下饱和氨水的pH<7
B. 向氨水中滴加过量硫酸,所有平衡均正向移动,pH增大
C. 电离是吸热过程,升高温度,所有平衡均正向移动
D. 向饱和氨水中加入适量NaOH固体,所有平衡均逆向移动,有NH3放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )
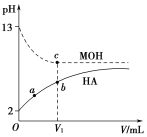
A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 == K2O+5X+16N2↑,下列说法不正确的是
A. X的化学式为Na2O
B. 每生成1.6molN2,则转移的电子为3 mol
C. 若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4 mol
D. 上述反应中NaN3被氧化,KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___________________mol·L-1。
(2)下列微粒:①S ②SO32- ③Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是________(填序号),只能表现出氧化性的是______(填序号)。
(3)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
(4)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(5)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
____Al+____NO3-+____□ ——____AlO2-______N2↑+____H2O,_____________
(6)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
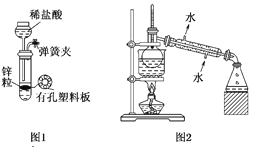
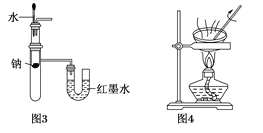
A. 用图1所示装置制取少量纯净的H2
B. 用图2所示装置分离K2CO3溶液和苯的混合物
C. 用图3所示装置验证Na和水反应的热效应
D. 用图4所示装置分离蒸干AlCl3 溶液制取无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究草酸分解的产物,设计的实验装置如图所示,下列说法正确的是

A. 实验开始时,先点燃A装置处的酒精灯,后点燃F装置处的酒精灯
B. B 装置中的现象为蓝色粉末变白,说明分解产物中有水生成
C. G装置中澄清石灰水变浑浊,说明分解产物中有CO生成
D. C、D、E装置中分别盛放澄清石灰水、浓硫酸、氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com