
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 == K2O+5X+16N2↑,下列说法不正确的是
A. X的化学式为Na2O
B. 每生成1.6molN2,则转移的电子为3 mol
C. 若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4 mol
D. 上述反应中NaN3被氧化,KNO3发生氧化反应
【答案】BD
【解析】
反应中NaN3中N元素化合价升高,被氧化,KNO3中N元素化合价降低,被还原,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,据此分析。
A、反应10NaN3+2KNO3 = K2O+5X+16N2↑,根据质量守恒可知,右边少10个Na、5个O,X的计量数为5,则X的化学式为Na2O,选项A正确;
B、氮元素由-![]() 价变为0价,每生成16molN2,则转移的电子为10mol,故每生成1.6molN2,则转移的电子为1 mol,选项B不正确;
价变为0价,每生成16molN2,则转移的电子为10mol,故每生成1.6molN2,则转移的电子为1 mol,选项B不正确;
C、若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4 mol,选项C正确;
D、反应中NaN3中N元素化合价升高,被氧化,KNO3中N元素化合价降低,被还原,发生还原反应,选项D不正确。
答案选BD。


科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
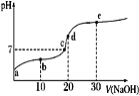
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。现进行如下图所示实验。下列有关说法正确的是

A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的固体物质一定是Fe2O3
C. 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol
D. 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由这些元素组成的二元化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
A. 原子半径:Y>Z>W>X
B. 简单气态氢化物的热稳定性:Z>Y
C. Q既能与强酸溶液反应,又能与强碱溶液反应
D. Y的最高价氧化物对应的水化物与Q溶液混合,无M生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号 | 加入的酸 | 加入酸的浓度/(mol/L) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基环己烷常用作气相色谱对比样品,也用于有机合成。
(1)乙基环己烷(C8H16)脱氢制苯乙炔(C8H6)的热化学方程式如下:
①C8H16(l)![]() C8H10(l)+3H2(g) ΔH1>0
C8H10(l)+3H2(g) ΔH1>0
②C8H10(l)![]() C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
③C8H6(l)+5H2(g)![]() C8H16(l) ΔH3=b kJ·mol-1
C8H16(l) ΔH3=b kJ·mol-1
则反应①的ΔH1为__________(用含a、b的代数式表示),有利于提高上述反应①的平衡转化率的条件是____(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)不同压强和温度下乙基环己烷的平衡转化率如下图所示。

①在相同压强下升高温度,未达到新平衡前,v正____(填“大于”“小于”或“等于”)v逆。
②研究表明,既升高温度又增大压强,C8H16(l)的转化率也升高,理由可能是____。
(3)t ℃,向恒容密闭反应器中充入1.00 mol C8H16(l)进行催化脱氢,测得液态C8H10(l)和C8H6(l)的产率x1和x2(以物质的量分数计)随时间变化关系如下图所示。

①在8 h时,反应体系内氢气的量为_____mol(忽略其他副反应),液态C8H16(l)的转化率是_________。
②x1显著低于x2的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中![]() 的比值变小,可采取的措施是( )
的比值变小,可采取的措施是( )
①加适量盐酸
②加适量NaOH(s)
③加适量KOH(s)
④加适量KHS(s)
⑤加水
⑥通H2S(g)
⑦加热.
A.②③④ B.①②⑤⑥⑦ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出反应的化学方程式_____________________________________________。
(2)现欲冶炼270吨铝,至少需要多少吨氧化铝?__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 氯气通入冷的氢氧化钠溶液中:Cl2 + 2OH = Cl + ClO + H2O
B. Fe与少量稀硝酸的反应:Fe + 4H+ + NO3 = Fe3+ + NO↑+ 2H2O
C. 碳酸钡溶于醋酸:BaCO3 + 2H+ = Ba2+ + H2O + CO2↑
D. 用石墨电极电解MgCl2 溶液:2Cl + 2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com