
【题目】工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出反应的化学方程式_____________________________________________。
(2)现欲冶炼270吨铝,至少需要多少吨氧化铝?__________________________
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 == K2O+5X+16N2↑,下列说法不正确的是
A. X的化学式为Na2O
B. 每生成1.6molN2,则转移的电子为3 mol
C. 若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4 mol
D. 上述反应中NaN3被氧化,KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表格是硫酸试剂标签上的部分内容。请回答下列问题:
硫酸 化学纯(CP)(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
(1)该浓硫酸中溶质、溶剂分子数目之比为______,现用该浓H2SO4来配制480 mL、0.3 mol·L-1的稀H2SO4,需量取该浓H2SO4的体积为______mL。
(2)配制时,下列仪器中必须使用 ______(填代号), 还缺少的仪器是______、______。
①托盘天平(带砝码) ②10 mL量筒 ③20 mL量筒 ④烧杯
⑤玻璃棒 ⑥100 mL容量瓶 ⑦漏斗 ⑧烧瓶
(3)在配制过程中,下列操作中能使所配溶液的浓度偏高的有____________(填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
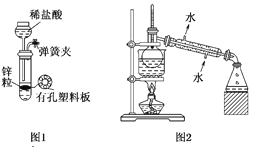
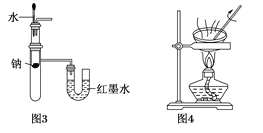
A. 用图1所示装置制取少量纯净的H2
B. 用图2所示装置分离K2CO3溶液和苯的混合物
C. 用图3所示装置验证Na和水反应的热效应
D. 用图4所示装置分离蒸干AlCl3 溶液制取无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g) + B(g)=== 2C(g)在某段时间内以A的浓度变化表示的化学反应速率为0.5mol L—1 min—1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A. 0.5mol L—1 min—1B. 1 mol L—1 min—1
C. 2 mol L—1 min—1D. 3 mol L—1 min—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJmol﹣1表示。请认真观察下图,然后回答问题.
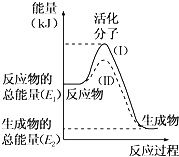
(1)图中所示反应是______(填“吸热”或“放热”)反应。
(2)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol碘反应生成HI会______(填“放出”或“吸收”)______ kJ的热量.在化学反应过程中,是将______ 转化为______。
(3)下列反应中,属于放热反应的是______,属于吸热反应的是______。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳⑤Ba(OH)28H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3气体,则原溶液中的Al3+浓度(mol/L)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。

回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com