
【题目】如下表格是硫酸试剂标签上的部分内容。请回答下列问题:
硫酸 化学纯(CP)(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
(1)该浓硫酸中溶质、溶剂分子数目之比为______,现用该浓H2SO4来配制480 mL、0.3 mol·L-1的稀H2SO4,需量取该浓H2SO4的体积为______mL。
(2)配制时,下列仪器中必须使用 ______(填代号), 还缺少的仪器是______、______。
①托盘天平(带砝码) ②10 mL量筒 ③20 mL量筒 ④烧杯
⑤玻璃棒 ⑥100 mL容量瓶 ⑦漏斗 ⑧烧瓶
(3)在配制过程中,下列操作中能使所配溶液的浓度偏高的有____________(填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
【答案】9:1 8.2 ②④⑤ 500 mL容量瓶 胶头滴管 ②③
【解析】
(1)假定该浓硫酸为100g,则溶质硫酸为98g,n(H2SO4)=1mol,溶剂水为2g,n(H2O)= ![]() =
=![]() mol,所以n(H2SO4 ):n(H2O)=1mol:
mol,所以n(H2SO4 ):n(H2O)=1mol:![]() mol=9:1,所以该浓硫酸中溶质、溶剂分子数目之比为9:1;
mol=9:1,所以该浓硫酸中溶质、溶剂分子数目之比为9:1;
质量分数为98%、密度为1.84gcm-3的浓H2SO4的物质的量浓度为:![]() mol/L=18.4mol/L,实验室没有480 mL规格的容量瓶,必须配制500mL,设需要浓硫酸的体积为VL,根据稀释定律,稀释前后溶质的物质的量不变,则VL×18.4mol/L=500mL×0.3molL-1,解得:V≈0.0082L=8.2mL;
mol/L=18.4mol/L,实验室没有480 mL规格的容量瓶,必须配制500mL,设需要浓硫酸的体积为VL,根据稀释定律,稀释前后溶质的物质的量不变,则VL×18.4mol/L=500mL×0.3molL-1,解得:V≈0.0082L=8.2mL;
(2)用液体配制溶液时用到的仪器有量筒、烧杯、容量瓶、玻璃棒、胶头滴管等,量筒选用10mL规格,故选②④⑤;还需要500mL容量瓶和胶头滴管;
(3)①量筒量取98%的硫酸时俯视会造成硫酸的体积偏小,浓度就偏低;
②洗涤了量取浓硫酸的量筒,会造成浓硫酸的量增多,浓度偏高;
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积偏小,根据cB=![]() 可得,配制的溶液的浓度偏高;
可得,配制的溶液的浓度偏高;
④配制溶液是需要加水,故容量瓶中有水对浓度没有影响;
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出,则会导致溶质减少,所以浓度偏低;
⑥定容后再加入蒸馏水,导致配制的溶液体积偏大,根据cB=![]() 可得,配制的溶液的浓度偏低;
可得,配制的溶液的浓度偏低;
⑦定容时,仰视刻度线,导致加入的蒸馏水体积偏大,根据cB=![]() 可得,配制的溶液的浓度偏低;
可得,配制的溶液的浓度偏低;
答案选②③。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列①~⑧中物质间的反应不能产生气体的是 ( )
①石灰石和盐酸 ②冷浓硫酸中投入铝片 ③石英与苏打混和加强热 ④石墨与高温水蒸气 ⑤过氧化钠与水 ⑥氟与水 ⑦钠与硫酸铜溶液 ⑧碳酸氢钠与氢氧化钠溶液
A.①和⑤B.④和⑦C.③和⑦D.②和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由这些元素组成的二元化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
A. 原子半径:Y>Z>W>X
B. 简单气态氢化物的热稳定性:Z>Y
C. Q既能与强酸溶液反应,又能与强碱溶液反应
D. Y的最高价氧化物对应的水化物与Q溶液混合,无M生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基环己烷常用作气相色谱对比样品,也用于有机合成。
(1)乙基环己烷(C8H16)脱氢制苯乙炔(C8H6)的热化学方程式如下:
①C8H16(l)![]() C8H10(l)+3H2(g) ΔH1>0
C8H10(l)+3H2(g) ΔH1>0
②C8H10(l)![]() C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
③C8H6(l)+5H2(g)![]() C8H16(l) ΔH3=b kJ·mol-1
C8H16(l) ΔH3=b kJ·mol-1
则反应①的ΔH1为__________(用含a、b的代数式表示),有利于提高上述反应①的平衡转化率的条件是____(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)不同压强和温度下乙基环己烷的平衡转化率如下图所示。

①在相同压强下升高温度,未达到新平衡前,v正____(填“大于”“小于”或“等于”)v逆。
②研究表明,既升高温度又增大压强,C8H16(l)的转化率也升高,理由可能是____。
(3)t ℃,向恒容密闭反应器中充入1.00 mol C8H16(l)进行催化脱氢,测得液态C8H10(l)和C8H6(l)的产率x1和x2(以物质的量分数计)随时间变化关系如下图所示。

①在8 h时,反应体系内氢气的量为_____mol(忽略其他副反应),液态C8H16(l)的转化率是_________。
②x1显著低于x2的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中![]() 的比值变小,可采取的措施是( )
的比值变小,可采取的措施是( )
①加适量盐酸
②加适量NaOH(s)
③加适量KOH(s)
④加适量KHS(s)
⑤加水
⑥通H2S(g)
⑦加热.
A.②③④ B.①②⑤⑥⑦ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:
N2+ 3H2![]() 2NH3(正反应是放热反应)。下列有关说法正确的是( )
2NH3(正反应是放热反应)。下列有关说法正确的是( )
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出反应的化学方程式_____________________________________________。
(2)现欲冶炼270吨铝,至少需要多少吨氧化铝?__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,下列有关说法正确的是
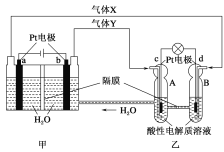
A. 图甲把化学能转化为电能,图乙把电能转化为化学能,水得到了循环使用
B. 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C. c极上发生的电极反应为O2+4H++4e-===2H2O
D. 图乙中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com