
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
【答案】 +4 BaCO3 + 2H+ = Ba2+ + CO2 ↑+ H2O 漏斗、 烧杯、 玻璃棒 取最后一次洗涤液少许于试管中, 滴加稀 HNO3 酸化的 AgNO3 溶液, 若无白色沉淀产生, 说明已洗净。 促进 TiCl4水解 60% 2.58×10-8
【解析】试题分析:本题以生产钛酸钡的工艺流程为载体,考查离子方程式的书写,基本实验操作,外界条件对盐类水解平衡的影响,产率和溶度积的计算等。
(1)BaTiO3中Ba的化合价为+2价,O的化合价为-2价,根据化合物中元素的正负化合价代数和为0,Ti的化合价为+4价。
(2)盐酸酸浸时反应的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2↑,离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑。
(3)①过滤操作中使用的玻璃仪器有烧杯、漏斗、玻璃棒。
②根据流程草酸氧化钛钡晶体吸附可溶性的Cl-等,要证明晶体已经洗净即证明洗涤液中不含Cl-。方法是:取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若无白色沉淀产生,说明已洗净。
(4)TiCl4水解的离子方程式为TiCl4+2H2O![]() TiO2+4HCl,加入大量水促进TiCl4水解,盐的水解是吸热过程,加热促进TiCl4水解,制备时加入大量的水同时加热,目的是促进TiCl4的水解。
TiO2+4HCl,加入大量水促进TiCl4水解,盐的水解是吸热过程,加热促进TiCl4水解,制备时加入大量的水同时加热,目的是促进TiCl4的水解。
(5)根据Ba守恒,理论上得到BaTiO3的质量为![]() 233g/mol=23.3g,BaTiO3的产率为
233g/mol=23.3g,BaTiO3的产率为![]() 100%=60%。
100%=60%。
(6)BaCO3的溶解平衡表达式为BaCO3(s)![]() Ba2+(aq)+CO32-(aq),Ksp(BaCO3)=c(Ba2+)·c(CO32-)=2.58
Ba2+(aq)+CO32-(aq),Ksp(BaCO3)=c(Ba2+)·c(CO32-)=2.58![]() 10-9,若浸出液中c(Ba2+)=0.1mol/L,则CO32-在浸出液中最大浓度c(CO32-)=
10-9,若浸出液中c(Ba2+)=0.1mol/L,则CO32-在浸出液中最大浓度c(CO32-)=![]() mol/L=2.58
mol/L=2.58![]() 10-8mol/L。
10-8mol/L。


科目:高中化学 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,,8.0DgCH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写山该反应的热化学反应方程式:____________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。
在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
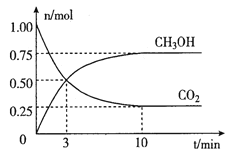
①从反或开始到平衡,CO2的平均反应速率v(CO2)=____。
②达到平衡时,H2的转化率为__________。
③下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mclCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 0molL﹣1 NaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示.下列说法正确的是( ) 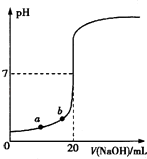
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100 molL﹣1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)化合物D中所含官能团的名称为__________________和_____________________。
(2)化合物E的结构简式为__________________;由B→C的反应类型是____________。
(3)写出C→D的反应方程式____________________________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有_____种。
I.属于芳香族化合物
II.能发生银镜反应
III.其核磁共振氢谱有5组波峰,且面积比为1:1:1:1:3
(5)请写出以甲苯为原料制备化合物![]() 的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= , 已知:K(300℃)>K(350℃),该反应是反应(填“放热”或“吸热”).
(2)图中表示NO2的变化的曲线是 , 用O2的浓度变化表示从0~2s内该反应的平均速率v= . 
(3)能说明该反应已经达到平衡状态的是 a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com