
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= , 已知:K(300℃)>K(350℃),该反应是反应(填“放热”或“吸热”).
(2)图中表示NO2的变化的曲线是 , 用O2的浓度变化表示从0~2s内该反应的平均速率v= . 
(3)能说明该反应已经达到平衡状态的是 a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.
【答案】
(1)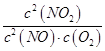 ;放热
;放热
(2)b;0.0015mol/(L?s)
(3)bc
(4)c
【解析】(1)化学平衡常数,是指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
K(300℃)>K(350℃),说明升高温度平衡向逆反应移动,故正反应是放热反应;(2)由表中数据可知,平衡时c(NO)= ![]() =0.0035mol/L,由方程式2NO(g)+O2(g)2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,据此判断表示NO2的浓度变化的曲线,
=0.0035mol/L,由方程式2NO(g)+O2(g)2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,据此判断表示NO2的浓度变化的曲线,
由图中数据可知2s内,NO的浓度变化量为0.01mol/L﹣0.004mol/L=0.006mol/L,根据v= ![]() 计算v(NO),再根据速率之比等于化学计量数之比计算v(O2);(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;(4)根据外界条件对反应速率与平衡的移动分析解答.
计算v(NO),再根据速率之比等于化学计量数之比计算v(O2);(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;(4)根据外界条件对反应速率与平衡的移动分析解答.
解(1)可逆反应2NO(g)+O2(g)2NO2(g)的平衡常数k= ![]() ,
,
K(300℃)>K(350℃),说明升高温度平衡向逆反应移动,故正反应是放热反应,
所以答案是: ![]() ,放热;(2)由方程式2NO(g)+O2(g)2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时c(NO)=
,放热;(2)由方程式2NO(g)+O2(g)2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时c(NO)= ![]() =0.0035mol/L,曲线b平衡时的浓度为0.0035mol/L,故曲线b表示NO2的浓度变化,
=0.0035mol/L,曲线b平衡时的浓度为0.0035mol/L,故曲线b表示NO2的浓度变化,
由图中数据可知2s内,NO的浓度变化量为0.01mol/L﹣0.004mol/L=0.006mol/L,故v(NO)= ![]() =0.003mol/(Ls),根据速率之比等于化学计量数之比,故v(O2)=
=0.003mol/(Ls),根据速率之比等于化学计量数之比,故v(O2)= ![]() v(NO)=
v(NO)= ![]() ×0.003mol/(Ls)=0.0015mol/(Ls),
×0.003mol/(Ls)=0.0015mol/(Ls),
所以答案是:b,0.0015mol/(Ls);(3)a.始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,故a错误;
b.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故b正确;
c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故c正确;
d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误;
故选bc;(4)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,平衡向逆反应移动,故b错误;
c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;
d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d错误;
故选c.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是

A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的说法不正确的是( )
A.化石能源物质内部贮存着大量的能量
B.海洋能、地热能是可再生的清洁能源
C.植物的光合作用使太阳能转化为化学能
D.燃料燃烧时只是将化学能转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol
(1)写出用CO2与H2反应制备甲醇的热化学方程式___________________________________。
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断
①压强P1_____P2(填“>”“<”或“=”,下同)
②平衡常数K(状态C)_____K(状态D)
③反应速率:V逆(状态A)_____V逆(状态B)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是______。
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
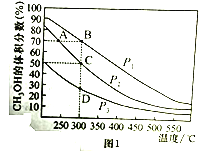
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是____________(填序号)。
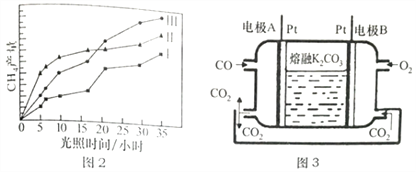
(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为______________,电极A处产生的CO2有部分参与循环利用,其利用率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入N2和H2,一定条件下发生反应N2+3H2![]() 2NH3,其反应速率与时间的关系如图所示。下列说法错误的是
2NH3,其反应速率与时间的关系如图所示。下列说法错误的是

A. t1时,v(正反应)>v(逆反应)
B. t2时,v(正反应) = v(逆反应)
C. 图中虚线表示的转化是N2+3H2→2NH3
D. 采取高温、高压和加催化剂,均有利于加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3 ⑧浓H2SO4
A. ①⑥ B. ①②③④⑥ C. ①②③⑥⑦⑧ D. ⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于生物体主要化学成分的叙述,不正确的是 ( )
A. 蛋白质的多样性与氨基酸的种类、数目、排序等有关
B. 脱氧核糖核酸是染色体的主要成分之一
C. 胆固醇、性激素、维生素D都属于脂质
D. 动物乳汁中的乳糖和植物细胞中的纤维素都属于多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。

(1)写出A、B、C三元素名称________、________、________。
(2)C在元素周期表中的位置是____________________。
(3)B的原子结构示意图为________________,C的氢化物与B的氢化物的稳定性强弱顺序为________>___________________(填化学式)。
(4)比较A、C的原子半径A________C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com