
【题目】用0.100 0molL﹣1 NaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示.下列说法正确的是( ) 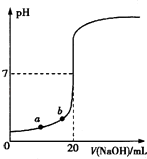
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100 molL﹣1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3
【答案】D
【解析】A.a点时加入NaOH较少,溶液中c(H+)较大,从影响水的电离平衡移动的角度分析;
B.加入NaOH溶液20.00mL时,酸碱恰好中和,根据c(酸)×V(酸)=c(碱)×V(碱)计算;
C.指示剂为酚酞,溶液变色范围为8.2~10,溶液呈碱性;
D.当滴加NaOH溶液10.00 mL时,酸过量,根据c(H+)= ![]() 计算溶液的pH.
计算溶液的pH.
解:A.a点时加入NaOH较少,溶液中c(H+)较大,c(H+)越大,水的电离程度越小,则有水电离出的氢离子浓度:a<b,故A错误;
B.加入NaOH溶液20.00mL时,酸碱恰好中和,由c(酸)×V(酸)=c(碱)×V(碱)可知,盐酸的物质的量浓度为0.100 molL﹣1,故B错误;
C.指示剂为酚酞,溶液变色范围为8.2~10,溶液呈碱性,NaOH过量,并不是恰好完全反应,故C错误;
D.当滴加NaOH溶液10.00 mL时,酸过量,c(H+)= ![]() =
= ![]() ×10﹣1mol/L,则pH=1+lg3,故D正确.
×10﹣1mol/L,则pH=1+lg3,故D正确.
故选D.


科目:高中化学 来源: 题型:
【题目】下列实验操作或实验装置(部分仪器已省略),正确的是
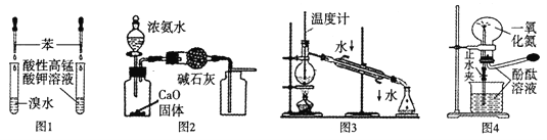
A. 用图1所示装置验证苯中是否有碳碳双键
B. 用图2所示装置制取并收集干燥纯净的NH3
C. 用图3所示装置进行石油的分馏
D. 用图4所示装置演示NO的喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( ) 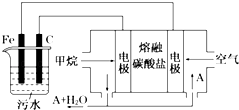
A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32﹣向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的说法不正确的是( )
A.化石能源物质内部贮存着大量的能量
B.海洋能、地热能是可再生的清洁能源
C.植物的光合作用使太阳能转化为化学能
D.燃料燃烧时只是将化学能转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入N2和H2,一定条件下发生反应N2+3H2![]() 2NH3,其反应速率与时间的关系如图所示。下列说法错误的是
2NH3,其反应速率与时间的关系如图所示。下列说法错误的是

A. t1时,v(正反应)>v(逆反应)
B. t2时,v(正反应) = v(逆反应)
C. 图中虚线表示的转化是N2+3H2→2NH3
D. 采取高温、高压和加催化剂,均有利于加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气制备有机中间体B和高分子I的一种合成路线如下(部分反应条件已略去):
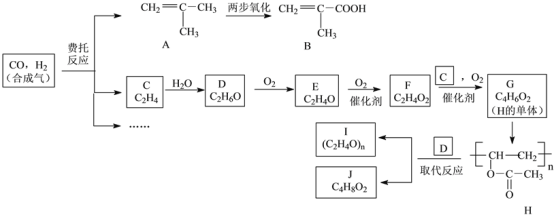
(1)B中所含官能团名称是____和____。
(2)G生成H的反应类型是____。
(3)D生成E的化学方程式为____;实验室由D和F制备J的化学方程式为____。
(4)G的结构简式为____;I的结构简式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com