
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3���壬Fe��OH��3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ���ǣ������� 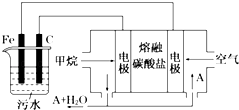
A.ʯī�缫�Ϸ���������Ӧ
B.����ͼʾ������AΪCO2
C.Ϊ��ǿ��ˮ�ĵ���������������ˮ�м��������Ҵ�
D.����ȼ�ϵ����CO32�������һ���ƶ�
���𰸡�B
����������װ��Ϊ���أ���װ��Ϊԭ���װ�ã�ԭ��ع���ʱ��ͨ������һ��Ϊ����������������Ӧ�������缫��Ӧ��CH4+4CO32����8e��=5CO2+2H2O��ͨ��������һ��Ϊ������������ԭ��Ӧ��������ӦΪO2+2CO2+4e��=2CO32����������FeΪ����������Fe��2e��=Fe2+��ʯīΪ�����������ĵ缫��ӦΪ��2H++2e��=H2�����Դ˽����⣮
�⣺A��ʯīΪ�����������ĵ缫��ӦΪ��2H++2e��=H2��������ʯī�Ϸ�����ԭ��Ӧ����A����
B�������������̼����Ϊ����ʣ�ͨ����缫Ϊ�����������缫��Ӧ��CH4+4CO32����8e��=5CO2+2H2O����Ӧ����CO2��������ӦΪO2+2CO2+4e��=2CO32������Ӧ����CO2����������AΪCO2����B��ȷ��
C��������Ҵ��Ƿǵ���ʣ�������ǿ�����ԣ���C����
D����������������ƶ���������CO32�������һ���ƶ�����D����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ܵ����Ҫ�ߴ��ȵĹ裬��ҵ���Ƹߴ��賣�����·�Ӧʵ��:
��Si(s) +3HCl(g)![]() SiHCl3(g) + H2(g) ��H= -381kJ/mol
SiHCl3(g) + H2(g) ��H= -381kJ/mol
��SiHCl3(g)+H2(g)![]() S(s) + 3HCl(g)
S(s) + 3HCl(g)
������������Ӧ������������������ȷ����
A. ������Ӧ�����û���Ӧ B. ��Ӧ�������ȷ�Ӧ
C. ������Ӧ��Ϊ���淴Ӧ D. ������Ӧ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ�ⷨ�����������Է�ˮ���õ�����Ni��ԭ����ͼ��ʾ������˵������ȷ������֪�� ��Ni2+����������Һ�з���ˮ��
�������ԣ�Ni2+����Ũ�ȣ���H+��Ni2+����Ũ�ȣ���������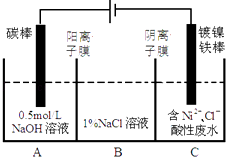
A��̼���Ϸ����ĵ缫��Ӧ��4OH����4e���TO2��+2H2O
B��Ϊ�����Ni�IJ��ʣ�����������Ҫ���Ʒ�ˮpH
C���������У�B��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ�С
D������ͼ��������Ĥȥ������
A.B���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��CO��CH4��CH3OH�ȶ�����Ҫ����Դ��Ҳ����ҪΪ����ԭ�ϡ�
��1����֪25�棬1.01��105Paʱ��,8.0DgCH4��ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�444.8kJ������дɽ�÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ��____________________��
��2��Ϊ���������ܼ�����������̼�����������ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����ҵ�Ͽ�����CO2������ȼ�ϼ״���
�����Ϊ2L���ܱ������У�����lmolCO2��3molH2��һ�������·�����Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
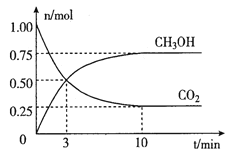
�ٴӷ���ʼ��ƽ����CO2��ƽ����Ӧ����v(CO2)=____��
�ڴﵽƽ��ʱ��H2��ת����Ϊ__________��
�����д�ʩ������߷�Ӧ���ʵ���__________��
A.�����¶� B.������� C.����ѹǿ D.��ʱ�����CH3OH
��3����ҵ��Ҳ��CO��H2Ϊԭ���Ʊ�CH3OH����Ӧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
A.��Ӧ��CO��CH3OH�����ʵ���֮��Ϊ1:1
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����1molCO��ͬʱ����1mclCH3OH
D.CH3OH�����������ڻ�������б��ֲ���
E.���������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۺ���ά���dz����Ķ�������һ�����������Ƕ�����ˮ��������������
��1��������Ũ����������ˮ�����������ǵĻ�ѧ����ʽΪ___________��
��2��ijѧ�����������ʵ�鷽�����Լ������ˮ��������
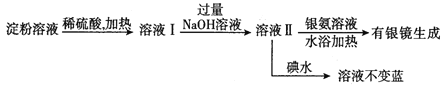
���н�����ȷ����_______��
A.�������в���δˮ�� B.��������ȫˮ��
C.����û��ˮ�� D.������ˮ��������֪�Ƿ���ȫˮ��
��3��һ�ֲⶨ�������������ʺ���(�������������������Ǽ���)�ķ���������
ȡij��ɫ����20.00mL����ϡ������У���ַ�Ӧ������ȴ����������������������Һ��ϡ����100.00mL��ȡ10.00mLϡ��Һ������30.00mL0.0150mol/L����Һ�����ڰ���15���ӡ�Ȼ��μ�2~3�ε�����Һ��ָʾ��������0.01200mol/LNa2S2O3����Һ�ζ���Ӧ��ʣ���I2������Һ����ɫ��Ϊ��ɫ�Ұ���Ӳ���ʱ����Ӧ�ﵽ�յ�,������Na2S2O3������Һ25.00mL����֪��
a.I2�ڼ������������������Ƿ�Ӧ��C6H12O6+I2+3NaOH=C6H11O7Na+2NaI+2H2O
b. Na2S2O3��I2�ܷ�ţ���·�Ӧ��I2+2Na2S2O3=2NaI+Na2S4O6
������100.00mL0.01500mol/LI2����Һ��������IJ����������ձ�������������ͷ�ιܺ�____��
���������м���ϡ���Ტ�����е�Ŀ����___________��
�ۼ�����������������ʵĺ���(��λmg/mL)(д���������)��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�����������������
A. n(H2CO3)��n(HCO3-)֮��Ϊ1mol��NaHCO3��Һ�У�����Na+��ĿΪNA
B. 17gH2O2�����Ǽ��Լ���ĿΪ0.5NA
C. ��״���£�H2��CO�������8.96L������O2�г��ȼ������O2������Ϊ0.2NA
D. 56g��������������Ӧ���������õ�3NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.100 0molL��1 NaOH��Һ�ζ�20.00mLδ֪Ũ�ȵ����ᣨ��̪��ָʾ�����ĵζ�������ͼ��ʾ������˵����ȷ���ǣ������� 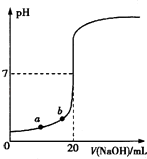
A.ˮ�������������Ũ�ȣ�a��b
B.��������ʵ���Ũ��Ϊ0.0100 molL��1
C.ָʾ����ɫʱ��˵��������NaOHǡ����ȫ��Ӧ
D.���μ�NaOH��Һ10.00 mL�����Է�Ӧǰ������仯�����û��Һ��pH=1+lg3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ƭ��ϡ���ᷴӦ��ȡ����ʱ�����д�ʩ�У�����ʹ�����������ʼӿ���� ��
A.����B.����ϡ���ᣬ����98����Ũ����
C.�μ���������ͭ��ҺD.������Ƭ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com