
【题目】淀粉和纤维素是常见的多糖,在一定条件下它们都可以水解生成葡萄糖。
(1)淀粉在浓硫酸作用下水解生成葡萄糖的化学方程式为___________。
(2)某学生设计了如下实验方案用以检验淀粉水解的情况:
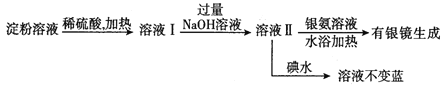
下列结论正确的是_______。
A.淀粉尚有部分未水解 B.淀粉已完全水解
C.淀粉没有水解 D.淀粉已水解,但不知是否完全水解
(3)一种测定饮料中糖类物质含量(所有糖类物质以葡葡糖计算)的方法如下:
取某无色饮料20.00mL加入稀硫酸煮沸,充分反应后,冷却,加入适量的氢氧化钠溶液并稀释至100.00mL。取10.00mL稀释液,加入30.00mL0.0150mol/L标准溶液,置于暗处15分钟。然后滴加2~3滴淀粉溶液作指示剂,再用0.01200mol/LNa2S2O3标准溶液滴定反应所剩余的I2,当溶液由蓝色变为无色且半分钟不变时,反应达到终点,共消耗Na2S2O3标推溶液25.00mL。己知:
a.I2在碱性条件下能与萄萄糖反应:C6H12O6+I2+3NaOH=C6H11O7Na+2NaI+2H2O
b. Na2S2O3与I2能发牛如下反应:I2+2Na2S2O3=2NaI+Na2S4O6
①配制100.00mL0.01500mol/LI2标准溶液,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和____。
②向饮料中加入稀硫酸并充分煮沸的目的是___________。
③计算该饮料中糖类物质的含量(单位mg/mL)(写出计算过程)。______________________。
【答案】 (C6H10O5)n+nH2O ![]() nC6H12O6(葡萄糖) D 100mL容量瓶 将饮料中的糖类物质都转化为葡萄糖( 对于10mL稀释液n(Na2S2O3)=0.012×0.025mol=3×10-4mol,剩余n{I2)剩余=1.5×10-4mol,n(糖)=n(I2)反应=0.03×0.015mol-1.5×10-4mol=3×10-4mol,则100mL稀释液中n(糖)=3×10-4mol×10=3×10-3mol,饮料中糖的含量=(3×10-3mol÷180g/mol)/20mL=0.027gmL/L=27.00mg/mL
nC6H12O6(葡萄糖) D 100mL容量瓶 将饮料中的糖类物质都转化为葡萄糖( 对于10mL稀释液n(Na2S2O3)=0.012×0.025mol=3×10-4mol,剩余n{I2)剩余=1.5×10-4mol,n(糖)=n(I2)反应=0.03×0.015mol-1.5×10-4mol=3×10-4mol,则100mL稀释液中n(糖)=3×10-4mol×10=3×10-3mol,饮料中糖的含量=(3×10-3mol÷180g/mol)/20mL=0.027gmL/L=27.00mg/mL
【解析】(1)淀粉在浓硫酸作用下水解生成葡萄糖。
(2)葡萄糖分子中含有醛基,银氨溶液与葡萄糖能发生银镜反应;碘水与淀粉相遇变蓝;利用相关的现象判定淀粉水解的程度。
(3)①配制100.00mL0.01500mol/LI2标准溶液,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL容量瓶。
②糖类物质在酸性条件下加热煮沸,使糖类物质发生水解,最终都转化为葡萄糖。
③根据a.I2在碱性条件下能与萄萄糖反应:C6H12O6+I2+3NaOH=C6H11O7Na+2NaI+2H2O和b. Na2S2O3与I2反应:I2+2Na2S2O3=2NaI+Na2S4O6关系,计算出20mL溶液剩余n{I2)剩余,再计算出与糖反应的n(糖)=n(I2)反应,再折算出100mL溶液中的含糖量,最后按要求计算出1mL饮料中含有多少mg的糖。
(1)淀粉在浓硫酸作用下水解生成葡萄糖的化学方程式为:(C6H10O5)n+nH2O ![]() nC6H12O6(葡萄糖);正确答案:(C6H10O5)n+nH2O
nC6H12O6(葡萄糖);正确答案:(C6H10O5)n+nH2O ![]() nC6H12O6(葡萄糖)。
nC6H12O6(葡萄糖)。
(2)葡萄糖分子中含有醛基,银氨溶液与葡萄糖能发生银镜反应,加入银氨溶液有银镜出现时,说明淀粉已经发生水解;碘水不变色但氢氧化钠溶液过量,碘能够与氢氧化钠溶液反应,所以无法判断溶液中是否还有淀粉,D正确;正确选项D。
(3)①配制100.00mL0.01500mol/LI2标准溶液,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL容量瓶;正确答案:100mL容量瓶。
②糖类物质在酸性条件下加热煮沸,使糖类物质发生水解,最终都转化为葡萄糖;正确答案:将饮料中的糖类物质都转化为葡萄糖。
③对于10mL稀释液n(Na2S2O3)=0.012×0.025mol=3×10-4mol,剩余n{I2)剩余=1.5×10-4mol,n(糖)=n(I2)反应=0.03×0.015mol-1.5×10-4mol=3×10-4mol,则100mL稀释液中n(糖)=3×10-4mol×10=3×10-3mol,饮料中糖的含量=(3×10-3mol÷180g/mol)/20mL=0.027gmL/L=27.00mg/mL;正确答案:对于10mL稀释液n(Na2S2O3)=0.012×0.025mol=3×10-4mol,剩余n{I2)剩余=1.5×10-4mol,n(糖)=n(I2)反应=0.03×0.015mol-1.5×10-4mol=3×10-4mol,则100mL稀释液中n(糖)=3×10-4mol×10=3×10-3mol,饮料中糖的含量=(3×10-3mol÷180g/mol)/20mL=0.027gmL/L=27.00mg/mL。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是

A.X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B.X是一种常温下能稳定存在的液态烃
C.X和乙烷类似,都容易发生取代反应
D.充分燃烧等质量的X和甲烷,X消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( ) 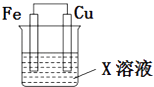
A.6种
B.5种
C.4种
D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子。在一定温度和压强下,1体积的A2气体和3体积的B2气体合成2体积的C气体,则C气体的化学式为:( )
A.AB3B.ABC.A3 BD.A2 B3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( ) 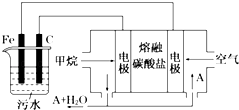
A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32﹣向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
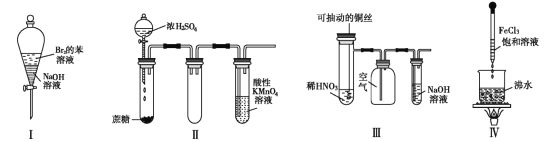
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5和PM10都是空气质量指数(AQI)的重要指标
B. 汽车尾气中的NO2和CO2都是大气污染
C. 聚乙烯和聚氯乙烯随意乱扔都能产生白色污染
D. 含N和P的大量污水任意排放都能导致水体富营养化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com