
【题目】下列物质名称书写正确的是( )
A. 石碳酸 B. 乙酸乙脂 C. 纯碱 D. 2,4,6—三溴笨酚
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中数据合理的是 ( )
A.用10 mL 量筒量取5.2 mL盐酸
B.用pH试纸测得某溶液的pH值为12.5
C.用托盘天平称取25.12gNaCl固体
D.用100 mL容量瓶配制150mL0.1 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )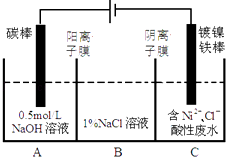
A.碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将
A.B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉和纤维素是常见的多糖,在一定条件下它们都可以水解生成葡萄糖。
(1)淀粉在浓硫酸作用下水解生成葡萄糖的化学方程式为___________。
(2)某学生设计了如下实验方案用以检验淀粉水解的情况:
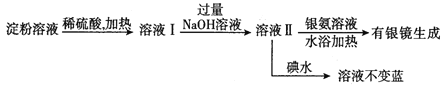
下列结论正确的是_______。
A.淀粉尚有部分未水解 B.淀粉已完全水解
C.淀粉没有水解 D.淀粉已水解,但不知是否完全水解
(3)一种测定饮料中糖类物质含量(所有糖类物质以葡葡糖计算)的方法如下:
取某无色饮料20.00mL加入稀硫酸煮沸,充分反应后,冷却,加入适量的氢氧化钠溶液并稀释至100.00mL。取10.00mL稀释液,加入30.00mL0.0150mol/L标准溶液,置于暗处15分钟。然后滴加2~3滴淀粉溶液作指示剂,再用0.01200mol/LNa2S2O3标准溶液滴定反应所剩余的I2,当溶液由蓝色变为无色且半分钟不变时,反应达到终点,共消耗Na2S2O3标推溶液25.00mL。己知:
a.I2在碱性条件下能与萄萄糖反应:C6H12O6+I2+3NaOH=C6H11O7Na+2NaI+2H2O
b. Na2S2O3与I2能发牛如下反应:I2+2Na2S2O3=2NaI+Na2S4O6
①配制100.00mL0.01500mol/LI2标准溶液,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和____。
②向饮料中加入稀硫酸并充分煮沸的目的是___________。
③计算该饮料中糖类物质的含量(单位mg/mL)(写出计算过程)。______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验

(1)A装置的试管中发生反应的化学方程式是_____________________;F装置的烧杯中发生反应的离子方程式是__________________________;B装置中的现象是_________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______________ 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是_________________。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是________________________________。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O,则a:b=______________。
cCu2S+dCuSO4+e H2O,则a:b=______________。
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为_________________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣) 【注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 0molL﹣1 NaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示.下列说法正确的是( ) 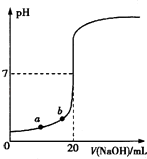
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100 molL﹣1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯.已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJmol﹣1CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJmol﹣1 则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式为;放电时,CO32﹣移向电池的(填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 molL﹣1 . 若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
(4)常温下,0.1molL﹣1NaHCO3溶液的pH大于8,则溶液c(H2CO3)c(CO32﹣)(填“>”、“=”或“<”),原因是(用离子方程式和文字说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 沙漠地区生长的仙人掌细胞中含量最多的化合物是水
B. 脱氧核糖分子中不含氧元素,是DNA的组成成分
C. 不同生物体的DNA和RNA的核苷酸排列顺序是不同的
D. 绝大多数生物体的遗传信息都存在于DNA分子中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com