
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如下图所示实验装置,回答下列问题。

(1)写出下列仪器的名称:
①_____________, ②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少 的仪器是_____________,将仪器补充完整后进行的实验操作的名称为________;②的进水口是______(填“f”或“g”)。实验中,仪器①中需加入沸石,其作用为________________________。
科目:高中化学 来源: 题型:
【题目】立方氮化硼CBN( Cubic Boron Nitrde)的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料,具有优异的耐磨性。其晶体结构如下图所示:
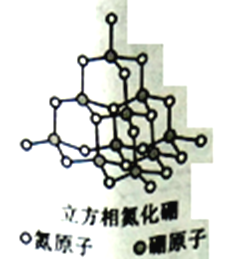
(1)基态氮原子的价电子层排布式是_____________,在氮和硼原子所在的周期中,第一电离能小于氮原子的有_____种元素的原子。
(2)氮原子和硼原子形成的化学键类型有_____________________。
(3)硼原子的杂化类型是_______,与硼原子紧相连的4个氮原子的空间构型是________,键角是_______ 。
(4)晶胞如图所示,该晶体属于______晶体。
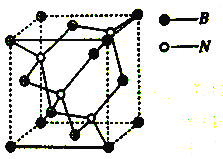
(5)晶体中所连接的最小环上是六元环,每个硼原子被_____个六元环共用,六元环最多有_____个原子在同一平面上。若晶胞边长为apm,立方氮化硼的密度是ρg/cm3,则NA的表达式是____(用a和ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是__________________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有______________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程,属于物理变化的是( )
A. 煤通过干馏制取焦炭 B. 石油通过分馏得到汽油
C. 煤通过气化和液化制取清洁燃料 D. 石油通过催化重整获得芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列各数值。
(1)3.1g Na2X含有Na+ 为0.1mol,则Na2X的摩尔质量为__,X的相对原子质量为__。
(2)8.5g氢氧根离子含有的电子数目为_______。
(3)14g C2H4与C4H8的混合物所含质子的物质的量为__。
(4)1.43g Na2CO3·10H2O溶于水配成100mL溶液,则c(Na2CO3)为__mol/L;取20mL该溶液,加入__mL水得到0.004mol/L的Na2CO3溶液(设稀释时对溶液体积的影响忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行制备Fe(OH)3胶体的实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25 mL沸水中逐滴加入FeCl3饱和溶液;煮沸至液体呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是________。写出此过程中的化学方程式_____________。
(2)证明制得的红褐色液体属于胶体,最简单实验操作是________。
(3)Fe(OH)3胶体是不是电解质:______(填“是”或“不是”)。
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶体的胶粒带_______电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是________。
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为______;继续滴加,沉淀减少甚至最终消失,写出化学方程式________。
④欲除去Fe(OH)3胶体中混有的NaCl,所用仪器物品是____;操作名称是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
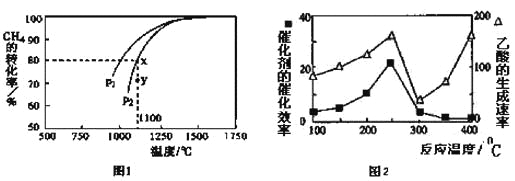
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com